Etanool
| See artikkel räägib etanoolist kui keemilisest ainest; aineklassi kohta vaata artiklit Alkoholid; etanooli sisaldavate jookide kohta artiklit Alkohoolne jook; filmi kohta artiklit Alkohol (film). |
| Etanool | |
|---|---|
 Etanooli molekuli mudel | |
| Üldised omadused | |
| Keemiline valem | CH3CH2OH ehk C2H5OH ehk C2H6O |
| Välimus | Värvuseta vedelik |
| Füüsikalised omadused | |
| Molekuli mass | 46,07 amü |
| Sulamistemperatuur | 159,15 K (−114 °C) |
| Keemistemperatuur | 351,15 K (78 °C) |
| Tihedus | 0,789×10³ kg/m³ |
| Lahustuvus | segunev |
| Kasutatakse SI-süsteemi ühikuid. Kui pole teisiti öeldud, eeldatakse normaaltingimusi. | |
Etanool ehk etüülalkohol ehk viinapiiritus (ka piiritus) ehk metüülkarbinool (valemiga CH3CH2OH) on tuntuim alkohol. See on normaaltingimustel värvuseta vedelik.
Etanooli leidub looduses nii vabalt (mõnedes taimedes, käärinud puuviljades ja marjades, hapupiimas) kui ka seotult taimede eeterlikes õlides. Samas esineb seda looduses vähe, kuna madala keemistemperatuuri tõttu lendub etanool kergesti. Seetõttu tuleb etanooli säilitada kinnises anumas.
Vahemere maade rahvad oskasid viinamarjamahla kääritamisel veini valmistada juba 4000 aastat eKr. Veinist õpiti etanooli tootma alles seoses destilleerimise leiutamisega 11. sajandil.
Etanool on tugeva toimega sõltuvust tekitav narkootiline aine, mis on enamikus riikides peale araabia maade legaalne. Selle sissevõtmine põhjustab emotsionaalseid muutusi, taju-, kõne-, mälu-, koordinatsiooni- ja tasakaaluhäireid. Etanooli 40-protsendilist vesilahust tuntakse viinana.
2022. aastal tarbiti Eestis elaniku kohta (vanuses 15 aastat ja üle selle) 10,3 liitrit absoluutalkoholi. Sama aasta kohta hinnati, et alkoholitarbimisest tingitud haiguste tõttu suri riigis 753 inimest.[1]
Etümoloogia
[muuda | muuda lähteteksti]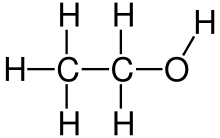
Nimetus "etanool" tuleneb IUPACi nomenklatuurist, kus tüviühendiks on kaks süsiniku aatomit (et-), nende vahel on üksikside (-an) ning kus funktsionaalrühm -OH annab järelliite -ool.
Etanooli sisaldavaid jooke nimetatakse alkohoolseteks. Kõnekeeles nimetatakse etanooli ka lihtsalt alkoholiks, kuna ta on tuntuim alkoholide aineklassi esindaja. Samuti oli "alkohol" etanooli varasem nimetus, sest viimane võeti kasutusele alles 1892. aastal[2].
Sõna "alkohol" tuleneb araabia keelest (الكحول – al-kuḩūl või الغول – al-ghawl), kus see tähistas algselt peent metallilist antimonipulbrit, mida kasutati silmalaugude tumedaks värvimiseks. Võimalikult väikeste osakestega antimonipulber saadi destilleerimise teel. Seda sõna hakati kasutama etanoolile viitamiseks alles 18. sajandi paiku.
Teine rahvapärane nimetus piiritus tuleneb ladinakeelsest nimest spiritus vini, mis tõlkes tähendab veini vaimu.
Keemilised omadused
[muuda | muuda lähteteksti]Etanool on värvuseta, iseloomuliku lõhnaga, kõrvetava maitsega hästi lenduv vedelik, mille sulamistemperatuur on −114 °C ja keemistemperatuur 78 °C. Etanool on veest kergem: selle tihedus 20 °C juures on 0,79 g/cm³. Etanool lahustab hästi orgaanilisi ühendeid, mistõttu kasutatakse seda lahustina.
Etanool lahustub veega igas vahekorras. Sealjuures esineb kontraktsioon, mis tähendab, et kahe aine segunemisel paigutuvad väiksemad aineosakesed suurematele vahele ära ja lõpptulemusena segu ruumala väheneb ehk tõmbub kokku. Näiteks 50 ml etanooli ja 50 ml vee segunemisel saadakse mitte 100 ml, vaid 94 ml lahust.
Etanooli lahustamisel vees esineb soojusefekt. See on eksotermiline protsess, kuna moodustuvad täiendavad keemilised sidemed.
Etanool põleb sarnaselt teiste orgaaniliste ainetega, moodustades süsinikdioksiidi CO2 ja vee: CH3CH2OH + 3O2 → 2CO2 + 3H2O
-
Etanooli ja vee segude sulamistemperatuurid.
-
Kesk-infrapunaspektroskoopia. OH-sidet märgib lainearv ~3300 cm−1 ja C-H sidet terav piik ~2950 cm−1 juures. Nende kahe piigi võrdlemist sensoriga kasutatakse laialdaselt etanoolisisalduse kiireks määramiseks bioetanooli tootmisel.
Tootmine
[muuda | muuda lähteteksti]
Etanooli saadakse kolmel põhilisel meetodil: pärmseentega (Sachharomyces sp.) kääritamisel, tselluloosi sisaldavate ainete töötlemisel või nafta krakkimisel eralduvates gaasides sisalduva eteeni hüdraatumisel.
Viinamarjade, puuviljade või teiste suhkruid sisaldavate lahuste või tärklist sisaldavate produktide kääritamisel kasutatakse pärmseeni. Kuna neid leidub alati õhus, puuviljades, marjades, pinnases ja vees, on suhkruid sisaldavate vedelike alkoholkäärimine looduses väga levinud. Seetõttu on selline kääritamine vanim alkoholi tootmise meetod ning seda tunti Lähis-Idas ja Vahemere maades juba mitu tuhat aastat eKr.
Pärmseente elutegevuse mõjul muundub glükoos etanooliks ja süsinikdioksiidiks: C6H12O6 → 2CH3CH2OH + 2CO2

Etanooli tootmisel kartulitest ja teraviljadest tuleb neis sisalduv tärklis muuta vastavate ensüümide (linnaste) toimel maltoosiks ja see edasi glükoosiks, mis jällegi pärmseente mõjul hapniku juurdepääsuta käärib lõpuks etanooliks. Pärmseente mõjul käärib ka piimas olev suhkur, mistõttu keefiris ja hapupiimas on umbes 0,5% etanooli. Kaljas on seda umbes 1% ja õlles tavaliselt 3–5%. Lähtematerjalina saab kasutada ka tööstuslikult toodetud suhkru lahust.
Puuvilja või mahla kääritamisel pärmseentega saadakse vein, milles on etanooli tavaliselt 10–15%. Kõrgema alkoholisisalduse korral pärmseened hukkuvad, mistõttu ei saa veini alkoholisisaldus suurem olla. On küll olemas spetsiaalselt aretatud kultuurpärmid, mis peavad vastu kuni 18% etanoolisisalduse. Kõrgema kontsentratsiooni saavutamiseks destilleeritakse segu kuni 80 °C juures. Tooretanooli destilleerimisel saadud ainet nimetatakse piirituseks. Pärast (sageli mitmekordset) destilleerimist saavutatakse alkoholi mahuosaks kuni 96%. Veevaba ehk 100% etanooli nimetatakse absoluutseks alkoholiks. Viimane saadakse sel moel, kui piiritusele lisada vett siduvaid aineid, näiteks benseeni, kaltsiumoksiidi või veevaba vask(II)sulfaati.
Puidutöötlemisjääkide (saepuru, puulaastud) ja teiste tselluloosi sisaldavate ainete (paber, kaltsud jm) töötlemisel rakendatakse suurt kuumust ja happeid, mille tagajärjel laguneb tselluloos suhkruks (glükoosiks). Suhkru kääritamisel saadakse etanool. Sellisel teel saadud etanooli nimetatakse hüdrolüüsipiirituseks. Kuna hüdrolüüsipiiritus sisaldab peale etanooli ka väga mürgist metanooli, siis sellisel viisil toodetud etanooli ei tohi juua. Keskmiselt saab ühest tonnist kuivast saepurust toota samapalju etanooli kui ühest tonnist kartulitest või 300 kg teraviljast.
Nafta krakkgaasides sisalduva eteeni hüdraatumine toimub kõrgemal temperatuuril (200–300 °C) ja rõhul (100 at) ning katalüsaatorite (fosforhape) manulusel. Eteeni hüdraatumisel (CH2=CH2 + H2O → CH3-CH2-OH) ehk veega liitumisel moodustub etanool, mida nimetatakse sünteetiliseks etanooliks.
Tehnilisteks vajadusteks toodetud etanooli denatureeritakse ehk muudetakse joomiskõlbmatuks. Selleks lisatakse sinna ohtlikke aineid (formaliin, püridiin jne). Denatureeritud etanooli äratundmiseks värvitakse see enamasti värviliseks.
Kasutusalad
[muuda | muuda lähteteksti]
Etanooli kasutatakse eelkõige alkohoolsete jookide tootmisel. Kääritamisel saadud alkohoolsed joogid on näiteks õlu, vein, siider, šampanja, sake, sonti, kumõss, kilju, mõdu, pulke, soju jt. Destilleerimisel saadud alkohoolsete jookide hulka kuuluvad viin, viski, konjak, brändi, liköör, rumm, džinn, tekiila, kalvados, slivovits, grappa, absint, akvaviit, nastoika, piiritus, puskar, pontikka jt.
Suur osa etanoolist läheb autokütuseks, eriti Ladina-Ameerikas, kus suhkruroo töötlemisel üle jääv etanool on väga odav. Etanooli saab kasutada mootorikütusena nii puhtal kujul kui ka segus bensiiniga. Tänapäeval lisatakse etanooli bensiinile enamasti muude lisandite (plii, aromaatsed ühendid jt) asemel. Etanooli oktaaniarv on väga suur, seetõttu suurendatakse sellega bensiini oktaaniarvu. Kuni 10% etanooli sisaldav bensiin sobib tavalistele bensiinimootoritele, suurema etanoolisisaldusega bensiini korral on tarvis mootoreid ümber seada. Euroopas muundatakse etanool enne bensiiniga segamist ETBE-ks (etüül-tert-butüüleeter), mille oktaaniarv on suur ja mis on vähem lenduv kui etanool.
Naftal põhinevate kütuste asendamist biokütustega (nagu bioetanool) on aga peetud küsitavaks, kuna see toob kaasa olulise toiduainete hinnatõusu[3] ja võib hoopis kasvatada kasvuhoonegaaside eraldumist[4].
Mitmed esimesed vedelkütusraketid, näiteks V2, kasutasid etanooli kütusena.
Teatud määral kasutatakse seda ka üldotstarbelise lahustina näiteks värvides, raviotstarbelistes tinktuurides ja kosmeetikatoodetes. Kosmeetikatoodete hulka kuuluvat odekolonni kasutavad alkohoolikud surrogaatalkoholina[5].
Etanoolil on antiseptiline toime, kuna lahustab lipiidseid membraane ja denatureerib valke.
Vaata ka
[muuda | muuda lähteteksti]Viited
[muuda | muuda lähteteksti]- ↑ "Arst: „mõistlik“ alkoholi kogus – kaks ühikut naistel ja neli ühikut meestel – on olnud inimeste petmine" Maaleht, 12. oktoober 2023
- ↑ Armstrong, Henry (1892). The International Conference on Chemical Nomenclature. Nature 46 (1177): 56–59
- ↑ Toiduhindu tõstavad spekulandid ja biokütused Novaator, 7. oktoober 2011
- ↑ Biokütuste kasutamine suurendab kasvuhoonegaaside emissioone Novaator, 17. november 2010
- ↑ Tervisekonverents: Eestis juuakse ülearu, alkohol on odav ja liiga kättesaadav Lääne Elu, 11. aprill 2013
Välislingid
[muuda | muuda lähteteksti]| Pildid, videod ja helifailid Commonsis: Etanool |
| Tsitaadid Vikitsitaatides: Etanool |
- Sissekanne Euroopa Liidu tervishoiuportaalis
- Kus on inimese alkoholilembuse juured? Novaator, 2. detsember 2014
- David J. Hanson, Ph. D., Drinking Alcohol and Cancer Risk


