Valgud
See artikkel ootab keeletoimetamist. (Veebruar 2021) |
| See artikkel räägib biopolümeeridest; perekonnanime kohta vaata artiklit Valk (perekonnanimi). |

Valgud ehk proteiinid on biopolümeerid, mille monomeerideks on aminohappejäägid. Valgu molekul koosneb paljudest järjestikustest aminohapetest, mis on omavahel seotud peptiidsidemega. Valkudel on oluline füsioloogiline roll kõikides organismides ja viirustes:
- struktuurne funktsioon, näiteks kollageen, mis osaleb luude ja naha moodustamisel;
- mehaaniline funktsioon, näiteks aktiin, mis võimaldab lihaste kokkutõmbumist;
- keemiline funktsioon ehk keemiliste reaktsioonide kiirendamine ja vahendamine (vt ensüümid).
Valke sünteesitakse ehk transleeritakse ribosoomide poolt raku tsütoplasmas. Valgu aminohappelise järjestuse määrab ära translatsioonil kasutatav mRNA nukleotiidahela järjestus.
Nimetus
[muuda | muuda lähteteksti]Nimetus "proteiinid" (kreeka keeles protos 'esimene, tähtsaim') pärineb hollandi keemikult Gerardus Johannes Mulderilt, kes võttis selle kasutusele 1839. aastal.[1]
Eestikeelse sõna "valk" lõi Johannes Voldemar Veski sõna "valge" põhjal.[2]
Ülesanded
[muuda | muuda lähteteksti]Valgud on kõige mitmekesisemad makromolekulid elusorganismides. Valkudel on organismis elutähtis roll, sest need osalevad põhimõtteliselt kõikides bioloogilistes protsessides: käituvad katalüsaatoritena, transpordivad ja hoiustavad teisi molekule (näiteks hapnikku), pakuvad mehaanilist tuge ja immuunkaitset, vastutavad rakuliikumise eest, osalevad närviimpulsside ülekandes, kontrollivad kasvu ja rakkude diferentseerumist.
Süstemaatika
[muuda | muuda lähteteksti]
Valgud jagunevad lihtvalkudeks ja liitvalkudeks. Liitvalkudes on lisaks lihtvalgulisele komponendile veel mittevalguline täiendav osis ehk prosteeriline rühm. Liitvalgud on näiteks fosfoproteiinid, metalloproteiinid, kromoproteiinid, proteolipiidid, glükoproteiinid jt. Lihtvalkude sekka kuuluvad näiteks albumiinid, globuliinid, histoonid, prolamiinid, gluteliinid, protamiinid ja skleroproteiinid.
Loomseid valke võib jaotada näiteks nende funktsiooni järgi järgmiselt:[1]
- struktuursed valgud
- ensüümvalgud
- transportvalgud
- kaitsevalgud
- kontraktiilsed valgud
- retseptoorsed valgud
- regulatoorsed valgud
- depoovalgud
- eksporditavad valgud
Struktuur ja koostis
[muuda | muuda lähteteksti]Valgud võivad koosneda ühest või mitmest peptiidist. Valgud koosnevad tuhandetest aminohapetest. Polüpeptiididest eristab neid see, et kui polüpeptiidide molekulmass on tavaliselt alla 10 000 daltoni, siis valkudel on see suurem. Molekulmass ei ole seotud bioloogiliselt aktiivsete valkude funktsiooniga. Polüpeptiidide ahelate pikkus on valkudes väga varieeruv, ulatudes sajast paarikümne tuhande aminohappejäägini. Enamik looduslikult esinevatest valkudest sisaldab alla 2000 aminohappejäägi.
Suurim teadaolev inimvalk on südamelihases paiknev titin aatommassiga 3–3,7 megadaltonit (3 000 000 daltonit); [3]
Peptiidid koosnevad aminohappejääkidest. Jääkideks kutsutakse neid seetõttu, et peptiidsideme moodustamisel on aminohape loovutanud vesinikuaatomi aminorühmast ja hüdroksüülrühma karboksüülrühmast, mis sideme tekkimisel eralduvad veemolekulina (dehüdratsioon). Ahela otsas olev vaba α-aminorühmaga jääki nimetatakse aminoterminaalseks (või N-terminaalseks), vaba karboksüülrühmaga jääki karboksüterminaalseks (või C-terminaalseks).

Valgud võivad koosneda kas ühest või mitmest polüpeptiidahelast. Mitmesubühikulised valgud sisaldavad kahte või enamat mittekovalentselt seotud polüpeptiidi, mis võivad olla kas identsed või erinevad. Kui vähemalt kaks ahelat mitmesubühikulises valgus on identsed, on valk oligomeerne ning identsed ühikud, mis koosnevad vähemalt ühest ahelast, on protomeerid. Üksikutel erandlikel valkudel võivad ahelad olla seotud kovalentselt ning sel juhul nimetatakse polüpeptiidahelaid subühikute asemel lihtsalt ahelateks.
Lihtsama struktuuriga valgu aminohappejääkide arvu saab umbkaudselt arvutada jagades molekulmassi 110-ga. Kuigi 20 tavalisema aminohappe keskmine molekulmass on 138 ühikut, esinevad valkudes enamasti väiksemad aminohapped, mille osakaale arvestades on valkude keskmise aminohappe molekulmass 128 ühikut, ning kuna peptiidsideme moodustumisel eraldub veemolekul (M=18 g/mol), taandub keskmine aminohappe molekulmass 110-le.
Valkude aminohappeline koostis on valgule iseloomulik suurus. Samas ei ole valgu täielik hüdrolüüs aminohapeteks valgu aminohappelise koostise määramiseks piisav, sest hüdrolüüsi käigus võivad esineda kõrvalreaktsioonid, näiteks teiseks aminohappeks üleminek või aminohappe täielik lagunemine. Täpse aminohappelise koostise määramiseks kasutatakse vajadusel lisaprotseduure, et hüdrolüüsiga kaasnevaid ebaselgusi lahendada.
Osa valke sisaldavad lisaks aminohapetele ka püsivalt assotsieerunud keemilisi komponente. Selliseid valke kutsutakse konjugeeritud valkudeks ja mitteaminohappelist osa prosteetiliseks rühmaks (lisarühmaks)[4]. Konjugeeritud valke liigitatakse prosteetiliste rühmade järgi (näiteks lipoproteiidid sisaldavad lipiide, glükoproteiinid sahhariidrühmi, metalloproteiidid spetsiifilisi metalle).
Valkude struktuuritasemed
[muuda | muuda lähteteksti]- Primaarne struktuur – aminohappeline järjestus. Polüpeptiidahel koosneb regulaarselt korduvast osast – peaahelast ehk selgroost ja muutuvast osast – kõrvalahelatest. Selgrool on suur vesiniksidemete moodustamise potentsiaal, sest iga aminohappejääk sisaldab karbonüülrühma, mis on hea vesiniksideme aktseptor, ning NH-rühma (erandina proliin), mis on hea vesiniksideme doonor. Need rühmad interakteeruvad üksteisega kui ka kõrvalrühmades olevate funktsionaalrühmadega, et konkreetseid struktuure stabiliseerida.
- Mõnedes valkudes on lineaarne polüpeptiidahel ristsidemetega seotud. Kõige tavalisem ristside on disulfiidsild, mis moodustub kahe tsüsteiinijäägi oksüdeerumisel. Tsüsteiinijääkide seondumisel moodustuvat kompleksi nimetatakse tsüstiiniks. Rakuvälistel valkudel on disulfiidisillad tavalised, kuid rakusisestel mitte. Harva esineb ka disulfiidsildade asemel teisi ristsidemeid (näiteks kollageenis).
- Sekundaarne struktuur – aminohappejääkide stabiilne kolmemõõtmeline struktuur (alfaheeliks või beetaleht), ka beetapööre ja oomegasilmus).

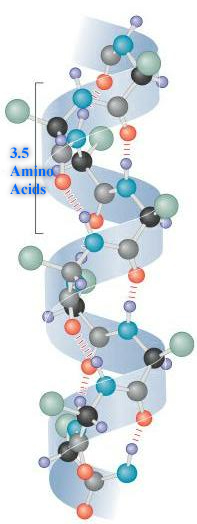
- Alfaheeliks – vardasarnane struktuur. Tihedalt pakitud selgroog moodustab varda sisemise osa ning kõrvalahelad on väljapoole suunatud helikaalse struktuuriga. Struktuuri stabiliseerivad peaahela NH- ja CO-rühmade vahelised vesiniksidemed. Iga aminohappejäägi CO-rühm moodustab vesiniksideme NH-rühmaga, mis asub nelja jäägi võrra eespool asuva aminohappejäägi küljes. Üks vesiniksidemetega seotud aminohappepaar moodustab ahelast 1,5 ongströmit (Å) ning keerab ahelat 100⁰ võrra (3,6 aminohappejääki ühe heeliksipöörde kohta).
- Beetaleht – polüpeptiidide ahel on peaaegu täielikult pikenenud, mitte tihedalt kokku pakitud nagu alfaheeliksis. Iga järgneva aminohappejäägi kõrvalahel on võrreldes eelmise jäägiga vastassuunas. Beetaleht moodustub kahe või enama beetaahela seostumisel vesiniksidemetega. Ahelad võivad olla ka vastassuunalised – antiparalleelne ebetaleht, või samasuunalised – paralleelne beetaleht. Enamikul juhtumitel on beetaleheks seostunud 4 või 5 ahelat, aga ahelate arv võib ulatuda kümneni või üle selle. Sellised beetalehed võivad olla ainult antiparalleelsed, ainult paralleelsed või segatüüpi. Beetalehed on suhteliselt lamedad, kuid on veidi väändunud.

- Tertsiaarne struktuur – kogu valgu kolmemõõtmeline struktuur. Polaarsed ja mittepolaarsed aminohappejäägid asuvad enamasti vastavalt struktuuri välispinnal ja sisemuses, sest vesilahustes on valkudel iseloomulik hüdrofoobseid aminohappejääke (näiteks leutsiin, valiin, metioniin, fenüülalaniin) veemolekulidest eraldada. Polaarseteks aminohapeteks on näiteks asparagiinhape, glutamiinhape, lüsiin ja arginiin. Mittepolaarsete osade varjamine vee eest põhineb NH- ja CO-rühmade vaheliste vesiniksidemete ning van der Waalsi interaktsioonide struktuuri stabiliseerivatel omadustel. Valkude kolmedimensioonilisi struktuure uuritakse röntgenkristallograafia ja tuumamagnetresonants-spektroskoopia (NMR või TMR) abil.
- Kvaternaarne struktuur – kahe või enama subühiku ehk alaühiku asend ruumis. Lihtsaim kvaternaarne struktuur on dimeer, mis koosneb kahest identsest subühikust (SU).
Christian Anfinsen kirjeldas 1950. aastatel aminohappejärjestuse ja valgukonformatsiooni vahelist seost ensüümi ribonukleaas põhjal.
Rakkudes takistavad valgul vale konformatsiooni võtmist erilised valgud – šaperonid (tugivalgud)[4].
Funktsioonid
[muuda | muuda lähteteksti]Valgu funktsioon on otseselt seotud tema kolmemõõtmelise struktuuriga. Seega kujutab valk endast ülekannet ühedimensioonilisest järjestusest kolmedimensiooniliste molekulideni, mis on võimelised mitmekülgseks aktiivsuseks. Kui valk kaotab struktuurimuutuste järel oma ensümaatilise aktiivsuse, on tegemist valgu denatureerumisega.
Paljude valkude funktsiooniks on teiste molekulide sidumine. Seotavat molekuli kutsutakse ligandiks. Ligandiks võib olla igat tüüpi molekul, ka valk. Ligandide mööduv seondumine on elusorganismis ülioluline, sest lubab organismil reageerida keskkonnamuutuste ja metabolismiseisunditele kiiresti ja pöörduvalt. Ligandi seostumise kohta valgus kutsutakse sidumiskohaks[4], mis on ligandi suuruse, kuju, laengu ja hüdrofiilsete või -foobsete omadustega komplementaarne. Ligandi seostumine on spetsiifiline, sest iga sidumiskoht saab interakteeruda vaid ühe või mõne ligandiga. See on väga tähtis elusorganismide kõrge organiseerituse säilitamiseks.
Ensüümid
[muuda | muuda lähteteksti] Pikemalt artiklis Ensüümid
Pikemalt artiklis Ensüümid
Valkude struktuur on liikuv. Konformatsioonimuutused võivad olla alates aminohappejääkide molekulaarsetest vibratsioonidest kuni mitmenanomeetriliste muutusteni segmentide liikumisel. Spetsiifilised konformatsioonilised muutused on sageli valgu funktsiooni jaoks vajalikud. Valgu ja ligandi seondumisega kaasneb enamasti ka konformatsioonimuutus, mis teeb sidumiskoha ligandi jaoks komplementaarsemaks, mis viib selle tugevama seondumiseni. Multisubühikulistes valkudes mõjutab ühe subühiku konformatsioonimuutus ka teiste subühikute kuju. Ensüümid on erilise funktsiooniga valgud, sest seondavad ja muudavad keemiliselt teisi molekule – katalüüsivad reaktsioone. Ensüümidega seonduvaid molekule kutsutakse ligandide asemel substraadiks ning ligandi seostumise kohta kutsutakse aktiivtsentriks[4]. Ensümaatiline katalüüs on elusorganismidele hädavajalik, sest bioloogiliselt vajalikes tingimustes on mittekatalüseeritud reaktsioonid enamasti aeglased, sest enamik bioloogilisi molekule on rakkudes oleva neutraalse pH, mõõduka temperatuuri juures ja veekeskkonnas üsna stabiilsed. Lisaks sellele ei ole mitmete vajalike biokeemiliste reaktsioonide toimumine soodustatud või on ebatõenäoline.
Ensüümid on väga efektiivsed katalüsaatorid. Nad muudavad madalamaks reaktsiooni aktivatsioonienergia ning suurendavad sellega reaktsiooni kiirust (106 pealt 1017-ni). Ensüümkatalüüsitud reaktsioonidele on iseloomulikuks substraadi ja ensüümi vahel tekkiv kompleks. Ensüüm ei mõjuta reaktsiooni tasakaalu. Seostumisenergiat saab kasutada substraadi entroopia madaldamiseks või ensüümis konformatsioonilise muutuse esilekutsumiseks. Seostumisenergia seletab ka ensüümide väga suure täpsuse substraatide suhtes.
Oluline osa ensümaatilise kiiruse suurendamiseks vajalikust energiast saadakse substraadi ja ensüümi vahel olevatest nõrkadest interaktsioonidest (vesiniksidemed ning hübrofoobsed ja ioonilised interaktsioonid). Ensüümi sidumiskoht on struktureeritud nii, et mõned nendest nõrkadest interaktsioonidest esinevad eelistatult reaktsiooni üleminekuolekutes, et neid stabiliseerida. Paljude interaktsioonide vajalikkus põhjustab ka selle, et ensüümid on suurte mõõtmetega.
Teised ensüümide kasutatavad katalüütilised mehhanismid on näiteks happe-aluse katalüüs, kovalentne katalüüs ja metalliiooni katalüüs. Katalüüs sisaldab mööduvaid kovalentseid interaktsioone substraadi ja ensüümi vahel või funktsionaalsete rühmade üleminekuid ensüümile või selle küljest.
Valgusüntees
[muuda | muuda lähteteksti] Pikemalt artiklis Valgusüntees
Pikemalt artiklis Valgusüntees
Valgusüntees on mitmeastmeline protsess, milles rakud taastoodavad valke. See algab aminohappe sünteesist ja tuumast pärineva DNA transkriptsioonist mRNA-ks, mis on hiljem translatsiooni alginformatsiooniks ning määrab valgu aminohappelise järjestuse. Translatsiooni viivad läbi ribosoomid, mis koosnevad rRNA-st ja valkudest. Selle käigus kinnitub ribosoom mRNA otsale ning liigub piki ahelat edasi, püüdes aminohapetega seondunud tRNA-sid ja lubades mRNA koodonitel paarduda sobivate tRNA antikoodonitega. tRNA küljes ribosoomi kantud aminohapejäägid liidetakse kokku peptiidsidemete abil ning vabad tRNA-d vabastatakse protsessist. Pärast võib aset leida veel valgu keemiline modifitseerimine, mida nimetatakse posttranslatsiooniliseks modifikatsiooniks, ja valgu voltumine.
Prokarüootide ja eukarüootide valgusüntees on erinev. Prokarüootides toimub translatsioon tsütoplasmas, eukarüootide puhul endoplasmaatilises retiikulumis.
Lühemaid valgujärjestusi osatakse tänapäeval sünteesida ka keemiliste meetodite abil. Seejuures on sel viisil võimalik mittekanooniliste aminohapete liitmine valgujärjestustesse.[5]
Valkude eraldamise meetodid
[muuda | muuda lähteteksti]
 Pikemalt artiklis Valkude puhastamine
Pikemalt artiklis Valkude puhastamine
Konkreetseid valke saab valkude segust eraldada mitmesuguste meetodite abil. Need on
- väljasoolamine – eri valgud sadestuvad erineva soolakontsentratsiooni juures;
- dialüüs – eraldamine läbi poolläbilaskva membraani;
- geelfiltratsioonkromatograafia – suuremate ja väiksemate molekulide erinev liikuvus läbi geeli;
- ioonivahetuskromatograafia – laenguga valkude seondumine kolonni;
- afiinsuskromatograafia – valkude afiinsus spetsiifiliste keemiliste rühmade suhtes;
- kõrgefektiivne vedelikkromatograafia (kõrgsurvevedelikkromatograafia).
Vaata ka
[muuda | muuda lähteteksti]Viited
[muuda | muuda lähteteksti]- ↑ 1,0 1,1 Männik, A. Biokeemia, Valgus 1985.
- ↑ Leksikoloogia: Sõnavara päritolu. Põlis-, laen- ja tehissõnad Eesti keele käsiraamat
- ↑ Opitz CA, Kulke M, Leake MC, Neagoe C, Hinssen H, Hajjar RJ, Linke WA (October 2003). "Damped elastic recoil of the titin spring in myofibrils of human myocardium". Proc. Natl. Acad. Sci. U.S.A. 100 (22): 12688–93. doi:10.1073/pnas.2133733100.PMC 240679. PMID 14563922. Veebiversioon (vaadatud 12.10.2013) (inglise keeles)
- ↑ 4,0 4,1 4,2 4,3 Eesti Biokeemia Selts – terminoloogia
- ↑ Nilsson, B. L., Soellner, M. B., & Raines, R. T. (2005). Chemical Synthesis of Proteins. Annual Review of Biophysics and Biomolecular Structure, 34, 91–118. http://doi.org/10.1146/annurev.biophys.34.040204.144700
Kirjandus
[muuda | muuda lähteteksti]- Nelson, D. L., Cox, M. M. Lehninger Principles of Biochemistry, Fourth Edition. New York : Freeman, 2005.
- Berg, J. M., Tymoczko, J L., Stryer, L. Biochemistry, Fifth Edition. New York : Freeman, 2002.
- Männik, A.. Biokeemia, Valgus 1985.
| Pildid, videod ja helifailid Commonsis: Valgud |
| Tsitaadid Vikitsitaatides: Proteiin |
