Kaksikside

Kaksikside on kovalentsete sidemete hulka kuuluv keemilise sideme tüüp, mille puhul sideme moodustamiseks on ühinenud kaks elektronpaari.[1] Seega osaleb selles neli sideme elektroni ja kaks siduvat elektronpaari.
Struktuurivalemites kujutatakse kaksiksidemeid kahe rööpjoonena (=) seotud aatomite vahel. Seda realiseeritakse sageli võrdusmärgina. Samuti kasutatakse elektrone tähistavaid punkte:

Kaksiksidemetega ühendeid nimetatakse ka küllastamata ühenditeks.
Näiteks propeeni molekulis on kaksikside: CH2=CH-CH3
Süsinikuaatom saab moodustada üksiksidemeid nelja aatomiga, näiteks metaani molekul koosneb ühest süsinikuaatomist, mis on nelja σ-sideme kaudu ühenduses nelja vesinikuaatomiga. Kaks süsinikuaatomit võivad omavahel moodustada ka kaksiksideme, lihtne näide on eteen.
Kaksikside võib esineda ka teiste aatomite vahel. Näiteks koosneb dihapniku põhivorm tripletne hapnik kahest hapnikuaatomist, mille vahel on kaksikside. Karbonüülrühm koosneb kaksiksidemes süsiniku- ja hapnikuaatomist. Imiinides on süsiniku ja lämmastiku vaheline kaksikside. Kõige tavalisemad kaksiksidemetega funktsionaalrühmad ja aineklassid on alkeenid, dieenid, karbonüülrühm (C=O), sulfoksiidid (S=O), imiinid (C=N) ja asorühmaga asoühendid (N=N). Kaksiksidemed süsiniku ja raskete elementide, näiteks väävli, fosfori, seleeni ja telluuri vahel on haruldasemad, sest suurte aatomite korral on orbitaalide kattumine tunduvalt vähem tõhus: aatomituumad on üksteisest kaugemal ja side on nõrgem. Sellised sidemed oksüdeeruvad kergesti.
Kaksiksidemed on tugevamad ja lühemad kui üksiksidemed.
Tavaliselt koosnevad nad ühest σ-sidemest ja ühest π-sidemest.
Sideme järk on 2.
Kaksiksidemed on elektronirikkad, mistõttu nad on reaktiivsed.

Kaksiksidemeid seletatakse tavaliselt molekulorbitaaliteooria alusel. Üksiksideme moodustavad ainult kaks elektroni: vastavad elektronpaarid kattuvad aksiaalselt, moodustades σ-sideme. Kaksiksidemes on kahest sidemest üks samuti σ-side, teine aga moodustab kahe p-orbitaali kattumisega π-sideme. Selle molekulorbitaali elektrone nimetatakse π-elektronideks. Nad ei asetse mitte kahe aatomi vahel, vaid sideme kohal ja all. Eteeni molekulis on kummalgi süsinikuaatomil kolm sp2-orbitaali ja üks p-orbitaal. Kolm sp2-orbitaali paiknevad ühel tasapinnal ja nad asetsevad omavahel võrdsete 120°-ste nurkade all. Kahe süsinikuaatomi lähenemisel ühed sp2-orbitaalid kattuvad, moodustades σ-sideme. Ka p-orbitaalid kattuvad, moodustades π-sideme.
Eteeni 133-pikomeetrine kaksikside on lühem etaani üksiksidemest (154 pm). Ta on tugevam (moodustumisenergia 636 kJ/mol) kui üksikside (368 kJ/mol), kuid kaksiksideme energia on väiksem kahekordsest üksiksideme (σ-sideme) energiast (2×368 = 736 kJ/mol), sest π-side on väiksema kattumise tõttu σ-sidemest nõrgem (seega ka laguneb kergemini). Sellepärast on kaksikside ka üksiksidemest reaktiivsem. Kaksiksidet sisaldavad ühendid on reaktiivsemad ja osalevad liitumisreaktsioonides.
Kaksiksideme tüübid
[muuda | muuda lähteteksti]| C | O | N | S | |
|---|---|---|---|---|
| C | alkeenid | karbonüülrühm | imiinid | tioketoonid, tiaalrühm |
| O | dihapnik | nitrosoühendid | sulfoksiidid, sulfoonid, sulfiinhapped, sulfoonhapped | |
| N | asoühendid | |||
| S | diväävel |
Kaksiksidemete paigutuse tüübid
[muuda | muuda lähteteksti]Mitme kaksiksidemega ühendeid nimetatakse polüküllastamata ühenditeks.

Molekulides, kus kaksiksidemed vahelduvad üksiksidemetega, võib p-orbitaali kattumine hõlmata ahela mitut aatomit, nii et tekivad konjugeerunud sidemed (kaks kaksiksidet, mida lahutab üks üksikside). Konjugeerunud sidemed mõjutavad teineteist, mis võib kaasa tuua nende stabiliseerumise. Sellepärast on konjugeerunud sidemetega ühendid sageli vähem reaktiivsed, kui kaksiksidemete olemasolu tõttu võiks arvata. Konjugeerumine esineb näiteks dieenides ja enoonides. Tsükliliste ühendite puhul võib konjugeerumine tekitada aromaatsuse. Sellistes süsteemides ei ole sideme järk enam täpselt 1 (üksikside) ega 2 (kaksikside), vaid mingi vahepealne arv, mis sõltub aatomite iseloomust ja vastastikusest asendist. Näiteks benseeni puhul on kahe mis tahes kõrvutise süsinikuaatomi sideme järk ligikaudu 1,5. Benseeni molekuli võib kujutleda kolme konjugeerunud kaksiksidet sisaldavana, nii et nende vastasmõju stabiliseerib benseenituuma (delokaliseeritud π-side). Sellepärast on benseen ja selle derivaadid vähem reaktsioonivõimelised kui vastavad tsükloalkeenid. Aromaatsed ühendid kujutavad endast tasapinnalist tsüklilist süsteemi, milles 4n + 2 π-elektroni (Hückeli reegel) võivad vabalt liikuda.

Vähemalt kaks kaksiksidet ja vähemalt kolm omavahel kaksiksidemetega ühendatud süsinikuaatomit moodustavad kumuleerunud kaksiksidemed. Kumuleenid on ühendid, milles on vähemalt kolm kumuleerunud kaksiksidet. Polüküllastamata ühendite hulka kuuluvad ka annuleenid ja polüüünid.[2]

Kui kaksiksidemed ei ole kumuleerunudega konjugeerunud, siis nad on isoleeritud.[3]
Metalli-ligandi mitmikside
[muuda | muuda lähteteksti]Metallid võivad osaleda metalli-ligandi mitmiksidemes.
Kaksiksidemereegel
[muuda | muuda lähteteksti]Kaksiksidemed on tavalisemad 2. perioodi elementidel ning haruldasemad kõrgemate perioodide elementidel (kaksiksidemereegel).
Cis-trans-isomeeria
[muuda | muuda lähteteksti] Pikemalt artiklis Cis-trans-isomeeria
Pikemalt artiklis Cis-trans-isomeeria
Kaksikside ei ole sümmeetriline, aatomite asend selle suhtes ei ole tähtsusetu. Sellest tuleneb cis-trans-isomeeria. Kui asendusrühmad on mõlemad samal pool kaksiksidet, on tegu cis-isomeeriga, kui eri poolel, siis trans-isomeeriga.
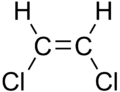 |
 |
|
| cis-1,2-dikloroeteen | trans-1,2-dikloroeteen | cis- ja trans-kaksikside rasvhapetele iseloomulikus süsivesinikuahelas |
Üksikasjad
[muuda | muuda lähteteksti]





Põhiolekus on süsinikuaatomil 6 elektroni, mis tiirlevad ümber aatomituuma. Werner Heisenbergi määramatuse relatsiooni järgi ei ole elektroni asukohta ja impulsimomenti võimalik korraga teada. Sellepärast räägitakse energiatasemetest või orbitaalidest. Orbitaal on aatomi elektronpilves koht, kus tõenäosus elektroni kohata on kõige suurem. Orbitaale tuleb mõista tõenäosustihedust väljendava matemaatilise lainefunktsiooni ruuduna. Lainefunktsioon ise võib olla positiivne või negatiivne ning kirjeldab amplituudi nulljoonest, kui sellist lainet graafikul kujutada. Igal orbitaalil saab olla 0 kuni 2 elektroni. Kui moodustub keemiline side, siis kaks aatomorbitaali kattuvad. Uuel orbitaalil, molekulorbitaalil on alati 2 elektroni. Seda protsessi nimetatakse aatomorbitaalide lineaarkombinatsiooniks.
Süsinikuaatomi põhiolekus on tema elektronkonfiguratsioon 1s2 2s22p2. Et moodustada sellist ühendit nagu metaan, on tarvis 4 vaba elektroni. Hapniku puhul on see põhiolekus võimatu, sest puuduvad vabad sideme elektronid. Sellepärast moodustab aatom hübriidorbitaalid: tekib 4 uut hübridiseeritud orbitaali, kõik sama energiatasemega. Selleks viiakse üks elektron 2s-orbitaalist 2p-orbitaali üle. Hübriidorbitaalide energia on väiksem kui 2p-orbitaalidel, kuid suurem kui 2s-orbitaali. Metaanis moodustab iga vesinikuaatom süsinikuga 1s-sp3-molekulaarorbitaali. Selles olekus saab orbitaalidevahelise ebasoodsa kauguse tõttu igal aatomil kattuda ja molekulaarorbitaali moodustada ainult üks orbitaal. Et moodustada kaksiksidet, tuleb moodustada teist tüüpi hübriidorbitaale: sp2-hübridiseeritud orbitaale. Sel puhul jääb üle üks p-orbitaal, mis asetseb risti tasandiga, millel paiknevad kolm sp2-hübridiseeritud orbitaali. Kattumine sp2-orbitaaliga annab σ-sideme. Kui moodustatakse see σ-side, siis võib tänu kahe 2p-orbitaali vahelisele soodsale kaugusele aset leida nende kattumine külgepidi. Kahest aatomorbitaalist tekib kaks molekulorbitaali, üks siduv ja teine antisiduv. Kui siduva orbitaali hõivavad kaks elektroni, siis on tegu π-sidemega. Sellised sidemed esinevad näiteks karbonüülrühmas ja alkeenides. Sidet on vähem tõhusa orbitaalide kattumise tõttu võimalik energia juurdeandmisega kergemini lõhkuda. Seejuures viiakse elektron üle siduvalt orbitaalilt antisiduvale, siis on ta allasurutud olekus. Sellepärast toimub näiteks eteenis kergesti halogeenide radikaalne liitumine või siis radikaalne polümeriseerumine (polüetüleeniks).
Kolmiksideme (näiteks alküünides) ja kahekordse kaksiksideme (näiteks süsinikdioksiidis ja alleenides) on tegu sp-hübridisatsiooniga ning kahe hübridiseeritud orbitaali kõrval on veel kaks p-orbitaali, mis asetsevad teineteisega risti. Sellepärast on võimalik kahekordne külgepidi kattumine, nii et tekivad π-sidemed.
Keemilise sideme moodustumisel hübridiseeruvad ja teised aatomid peale süsinikuaatomi. Lämmastik moodustab ammoniaagis (NH3) neli sp3-hübridiseeritud orbitaali, millest ühel paikneb vaba elektronpaar.
2. perioodi aatomite sidet saab kirjeldada sp2-hübriidorbitaalidega. Niisuguse sp2-hübridisatsiooniga aatomi naaberaatomid paiknevad ühel tasandil (molekul on tasandiline). Seotud elektronpaaride vahelised nurgad on tavaliselt 120° (vt valentskihi elektronpaaride tõukumise mudel), siduvate aatomite vaheline kaugus on tavaliselt 1,34 Å. Ülejääv elektron paikneb molekulitasandiga risti puht-p-iseloomuga orbitaalil. Kummalgi kaksiksidemega seotud aatomil on niisugune lihtsalt hõivatud p-orbitaal. Nende kahe kombinatsioonist tekib siduv π-orbitaal ja antisiduv π*-orbitaal.
Seda tüüpi kaksiksidemed ei esine küll ainult 2. perioodi puhul, kuid kõrgemate perioodide elementide vahelistel kaksiksidemetel on teised sidememustrid. Selle põhjuseks on üldiselt väiksemat homonukleaarsed sidemeenergiad ning s- ja p-valentsorbitaalide väiksem hübridiseerumistendents. Nende asjaolude koostoimel juhtub mõnikord, et kaksiksidemesüsteemi aluseks olevate molekulifragmentide sideme moodustamiseks vajalikku olekusse viimiseks vajalikku energiat järgnevalt vabanev sidemeenergia enam ei korva. Niisugustel juhtudel saadakse need fragmendid (st karbeenidega homoloogsed või analoogsed molekulid) isoleeritavate ühenditena või siis toimub dimeriseerumine kahekordse Lewise happe-aluse reaktsiooni kaudu ning saadakse kaks doonor-aktseptorsidet (kaksikdatiivne side). Säärane kaksikside, mida esineb näiteks süsiniku kõrgematel homoloogidel, on äratuntav iseloomuliku struktuuri (asendajate trans-bent-nurk) ning väikese dissotsiatsioonienergia järgi. Viimane võib olla isegi tunduvalt väiksem kui tavalise kovalentse üksiksideme puhul. Selliste kaksiksidemesüsteemide tüüpilised näited on distanneenid (R2Sn=SnR2) ja diplumbeenid (R2Pb=PbR2).
Siduva π- ja antisiduva π*-orbitaali vaheline energialünk on reeglina väiksem kui vastava σ- ja antisiduva σ*-orbitaali vahel. konjugeerunud kaksiksidemete korral väheneb ergastusenergia niivõrd, et juba nähtavast valgusest võib piisata elektroni tõstmiseks tühja orbitaali. Selleks on tarvis seda vähem energiat (seda suurema lainepikkusega energiast), mida suurem on konjugeerunud kaksiksidemete arv (vt lõpmata kõrgete seintega potentsiaaliauk). 11 konjugeeritud kaksiksidemega karoteeni puhul neelatakse sinine valgus ning molekul paistab oranžina (täiendvärvus oranž tekib sinise osa lahutamisel pealekiiratud valgest valgusest.
Sidemepikkus ja sidemenurk
[muuda | muuda lähteteksti]Kahe aatomi kaksiksidemete sidemepikkused mittekonjugeerunud süsteemides on väiksemad kui samade aatomite vahelistel vastavatel üksiksidemetel.[4]
Valitud kaksiksidemete sidemepikkus ja sidemenurk 
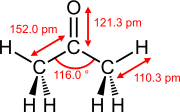

Eteen Atsetoon Dimetüülsulfoksiid
Kaksiksideme alternatiivne mudel
[muuda | muuda lähteteksti]Eeltoodud mudeli, mille järgi kaksikside on σ-sideme ja π-sideme kombinatsioon, esitas 1930. aastal valentssidemete teooria raames Erich Hückel.[5] Hückeli mudel on alates 20. aastate lõpust õpikutes esitatav mudel.
Linus Pauling esitas mudeli, mille järgi kaksikside tuleneb kahest ekvivalentsest sidemest,[6], mida hiljem hakati nimetama banaanisidemeteks ehk τ-sidemeteks ehk painutatud sidemeteks.[7] Oma seisukoha esitas Pauling ka 1958. aastal Londonis peetud teoreetilise orgaanilise keemia sümpoosionil.[8] Pauling pööras erilist tähelepanu elektronide korrelatsioonile: "Elektronide vastasmõju (tõukumine) võib etendada painutatud sidemete stabiilsuse suurendamisel üsna olulist osa..." Kaksik- ja kolmiksidemete kirjeldamine painutatud sidemete idee abil seletab hästi mõningaid nende omadusi. Nimelt, kui kordsetel sidemed on 1,54 Å (lihtsa süsinik-süsiniksideme pikkus) pikkuste kaarte kujulised ja nende algsuund langeb kokku tetraeedrilisega, siis nende arvutatud pikkus osutub võrdseks 1,32 Å-ga kaksiksideme puhul ja 1,18 Å-ga kolmiksideme puhul, mis on heas kooskõlas eksperimentaalsete väärtustega 1,33 ja 1,20 Å. Elektronide elektrostaatilise tõukumise ideed on edasi arendanud Roland Gillespie valentskihi elektronide elektronpaaride tõukumise teooria.[9]
Praegu veel vaieldakse, kumb mudel on parem,[10] kuigi mõned keemiateoreetikud peavad neid mudeleid praktiliselt ekvivalentseteks. Kenneth B. Wiberg jõudis 1996 järeldusele, et "kuigi praegu saadaval oleva info põhjal ei saa teha lõpliku järeldust, tundub tõenäoline, et eteeni σ/π- ja painutatud sideme kirjeldust võib pidada samaväärseteks.",[11] Ian Fleming läheb 2010. aasta õpikus kaugemale, märkides, et "elektronide üldine jaotus [...] on täpselt sama".[12]
Kaksiksidemega molekulide tüüpilised keemilised reaktsioonid
[muuda | muuda lähteteksti]- C=C-kaksikside (alkeenid):
- Elektrofiilne liitumine kaksiksidemele
- veel üks (elektrofiilne) molekul ühineb kas pärast E+ (E+ = elektrofiil) atakeerimist molekuliga, ning ioonilist vaheastet, kusjuures kaksikside katkeb, või suuremate aatomitega (näiteks broom) korral moodustub ringikujuline iooniline vaheaste ("-ooniumioon", siin niisiis bromooniumioon) ning seejärel atakeeritakse jääki (näites Br−) tagant.
- radikaalne liitumine kaksiksidemele
- molekul, mille side on kergesti homolüütiliselt (kaheks radikaaliks) lõhestatav (näiteks dikloor) lõhestub valguse (ultraviolettkiirguse) käes kaheks radikaaliks, mis seejärel ründavad kaksiksidet.
- Elektrofiilne liitumine kaksiksidemele
- C=O-kaksikside (karbonüülrühm, ketoonid, aldehüüdid, karboksüülhapped, karboksüülhapete estrid):
- C=O-sideme reduktsioon alkoholideks redutseerivate reagentidega (näiteks vesinik) või Grignardi reaktsioonid.
- C=O-sideme (ainult aldehüüdil) oksüdatsioon ksrboksüülhappeks.
- Passerini reaktsioon.
- C=N-kaksikside
- Sinihappe liitmine α-aminonitrileeni moodustumisega.
- Ugi reaktsioon
- peritsüklilised reaktsioonid
Vaata ka
[muuda | muuda lähteteksti]C=C-kaksiksidemete tõestamine
[muuda | muuda lähteteksti] Pikemalt artiklis Alkeenid
Pikemalt artiklis Alkeenid
C=C-kaksiksidemetega orgaanilisi ühendeid, sealhulgas alkeene, saab üsna mittespetsiifiliselt tõestada broomvee abil. Alkeeni kohalolu korral kaotab dibroomiga (Br2) kollaseks värvunud broomivesi pärast aineprooviga loksutamist värvuse. Liitumisreaktsiooni tulemusena tekib alkeenist bromoalkaan.
Rasvad ja õlid
[muuda | muuda lähteteksti]Küllastamata side rasvhapetes teeb nad vedelamaks kui tavalised küllastunud rasvhapped. Küllastamata rasvhapped teevad õlid vedelaks (päevalilleõli) ja rasvad pehmeks (rasv). Küllastamata rasvhapped on näiteks oleiinhape, linoolhape ja α-linoleenhape, mille molekulides on vastavalt üks, kaks ja kolm kaksiksidet.
Divesiniku liitmisega rasvhappeahelatele saab nikli kui katalüsaatori juuresolekul konverteerida kaksiksidemed üksiksidemeteks. Seda nimetatakse hüdrogeenimiseks. Sulamistemperatuur seejuures tõuseb.
Ajalugu
[muuda | muuda lähteteksti]Kaksiksidemeid hakkas kaksikjoontega kujutama Joseph Loschmidt või Aleksandr Butlerov.
Vaata ka
[muuda | muuda lähteteksti]- Kaksiksidemereegel
- Küllastamatuse aste
- Cis-trans-isomeeria
- π-π-vastastikmõju
- Mitmikside
- Kolmikside
- Konjugeerunud sidemed
- Üksikside
- Nelikside
- Viisikside
- Küllastatud ühend
- Küllastamata ühend
Märkused
[muuda | muuda lähteteksti]- ↑ Orchin, Macomber, Pinhas, Wilson. The Vocabulary and Concepts of Organic Chemistry, 2. trükk, John Wiley & Sons, 2005, ISBN 0-471-68028-1.
- ↑ IUPAC GOLDBOOK, cumulative double bonds
- ↑ IUPAC GOLDBOOK, isolated double bonds
- ↑ Siegfried Hauptmann. Organische Chemie, 2. ümbertöötatud trükk, VEB Deutscher Verlag für Grundstoffindustrie: Leipzig 1985, lk 54, ISBN 3-342-00280-8.
- ↑ Erich Hückel. Zur Quantentheorie der Doppelbindung. –Zeitschrift für Physik, 1930, kd 60, nr 7-8, lk 423–456. Resümee.
- ↑ Linus Pauling. The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules. – Journal of the American Chemical Society, 1931, kd 53, nr 4, lk 1367–1400. Esimene lehekülg.
- ↑ Claude E. Wintner. Stereoelectronic effects, tau bonds, and Cram's rule. – Journal of Chemical Education, 1987, lk 64, nr 7, lk 87. Resümee.
- ↑ Полинг Л. Кекуле и химическая связь. — Р. Х. Фрейдлина (toim). Теоретическая органическая химия, М.: Издательство иностранной литературы 1963, lk 7–16.
- ↑ Гиллеспи Р. Геометрия молекул, М.: Мир 1975.
- ↑ William E. Palke. Double bonds are bent equivalent hybrid (banana) bonds. – Journal of the American Chemical Society, 1986, kd 108, lk 6543–6544. Kaks esimest lehekülge.
- ↑ Kenneth B. Wiberg. Bent Bonds in Organic Compounds. – Accounts of Chemical Research, 1996, 29 (5), lk 229–234.
- ↑ Ian Fleming. Molecular Orbitals and Organic Chemical Reactions, Wiley: London 2010, ISBN 0-470-74658-0, lk 61.



