Valentssidemete teooria
Valentssidemete teooria (ingl k valence bond theory; VB-teooria) ja molekulaarorbitaalide teooria on kaks põhilist teooriat keemias, mis selgitavad keemilist sidet kvantmehaanika meetodite kaudu. Valentssidemete teooria on viis molekuli struktuuri kvantmehaaniliseks kirjeldamiseks, kus kovalentne side moodustub aatomorbitaalide liitumisel (kattumisel). VB-teooria võimaldab kirjeldada elektronide jaotust molekulis, olles samaaegselt Lewise ja VSEPRi teooriatest laiaulatuslikum, sest annab võimaluse arvutada sidemepikkuste ja sidemetevaheliste nurkade arvulised väärtused.[1]
Ajalugu[muuda | muuda lähteteksti]
Pärast seda, kui Gilbert Newton Lewis oli 1916. aastal esitanud idee kovalentsest sidemest, tekkis teadusringkondades üldine huvi uurida, mis mehhanismi kaudu keemiline side tekib. Selle probleemi kallal töötasid koos Walter Heitler ja Fritz London. 1927. aasta suvel avaldasid Heitler ja London artikli, milles näitasid, et vesiniku aatomis tekib side tänu kvantmehaanilisele vastastikmõjule, mis lubab elektronidel aatomite vahel asendeid muuta.[2] Teos oli murranguline, kuna senini ei olnud aru saadud, kuidas neutraalsed aatomid seostuvad. Heitleri-Londoni tööst sai valentssidemete teooria alus. 1928–1933 arendasid teooriat veel Slater, Pauling jt. Tekkisid mitmed täiustused nagu orbitaalide hübridisatsioon, resonantsstruktuurid. Samuti hakati kasutama parandusfunktsioone kvantitatiivsete tulemuste parandamiseks (polarisatsioonifunktsioonid, ioonilised vormid).[3]
Füüsikaline sisu[muuda | muuda lähteteksti]





Selle teooria järgi moodustub aatomite vahel kovalentne side nende täitumata valentsorbitaalide kattumisel. Kattumise korral elektronid paarduvad (elektronid saavad vastasmärgilise spinni: üles-alla) ja orbitaalide kattumise alas interfereeruvad lainefunktsioonid konstruktiivselt. Teisisõnu kasvab orbitaalile vastava lainefunktsiooni amplituud ja seega tõuseb ka elektroni leidumise tõenäosus orbitaalide kattumisalas. See omakorda on kooskõlas Lewise teooriaga keemilisest sidemest (sideme moodustavad kaks elektroni).[4]
Sigma- ja pii-sidemete tekkimine[muuda | muuda lähteteksti]
Aatomorbitaalid saavad kattuda mitut moodi. Näitena võib vaadelda H2O molekuli teket. Hapniku elektronkonfiguratsioon valentskihil on
2s2 2px2 2py1 2pz1
Kaks p-orbitaali elektroni on paardumata. Igal vesiniku aatomil on 1s1-elektron, mis saab paarduda hapniku 2p-elektroniga. Selleks peavad vesiniku aatomi s-orbitaal ja hapniku aatomi p-orbitaal kattuma. Hapniku ja vesiniku tuumi ühendavale sirgele moodustub side, mida nimetatakse sigma-sidemeks (σ-side). Seega vastavalt VB-teooriale on kaks vesinikku seotud hapniku aatomiga vesiniku 1s-elektroni ja hapniku 2p-elektroni paardumisel moodustunud σ-sideme kaudu. Sellist osakeste süsteemi on võimalik kirjeldada lainefunktsiooni abil ja Schrödingeri võrrandit kasutades saab süsteemi jaoks arvutada energia ja sidemepikkused. Viimase saab teada, kui varieerida tuumadevahelist kaugust ning leida pikkus, mille puhul energia on minimaalne. Terminit sigma-side kasutatakse keemias laialdaselt sidemete kohta, milles elektrontiheduse silindrikujuline jaotus on sarnane hapniku-vesiniku sidemele. Siiski pole see ainuvõimalik keemiline side, nagu tuleb välja, kui uurida lämmastiku molekuli N2. Lämmastiku valentselektronkihi elektronkonfiguratsioon on
2s2 2px1 2py1 2pz1
Kui kahe lämmastiku aatomi z-telje sihilised orbitaalid kattuvad, siis nende elektronid saavad paarduda ja moodustada σ-sideme. 2px-orbitaalid asetsevad nüüd otsapidi kattumise jaoks ebasoodsalt, kuid külgepidi kattumine on igati võimalik. Niisiis kattuvad 2px-orbitaalid küljeti. Tekkivat elektronjaotust nimetatakse pii-sidemeks (π-side). Sigma-sidemega sarnaselt aitab π-side hoida aatomeid koos, aga kuna maksimaalse elektrontiheduse piirkond π-sideme korral ei asu tuumadevahelisel sirgel, vaid sellest ülal ja allpool, siis pole π-side nii tugev tuumade kooshoidja kui σ-side. Sarnaselt 2px-ga saavad 2py-orbitaalid kattuda, elektronid paarduda ning tulemuseks on teine π-side. Kokkuvõttes ühendab lämmastiku aatomeid N2-molekulis üks σ-side ja kaks π-sidet. See vastab hästi Lewise struktuurivalemile :N≡N:. Lewise struktuurivalem VB-teooria kaudu:
- üksikside: σ-side
- kaksikside: σ-side ja π-side
- kolmikside: σ-side ja kaks π-sidet.[4]
Elektronide ergastamine[muuda | muuda lähteteksti]
Süsinik peaks oma elektronkonfiguratsiooni
2s2 2px1 2py1
järgi andma ühendeid CX2. Ometi on teada, et süsinik annab vesinikuga reageerides metaani molekuli CH4. Süsinik annab tavaliselt neli sidet ja tundub, et VB-teooria siin ei kehti. Probleem lahendub tänu sellele, et ainult molekuli üleüldine energia on oluline: niikaua, kuni protsessi tulemusena energia väheneb, võib mingis etapis ka energia neelduda. VB-teooria selgitab süsiniku neljavalentsust elektroni ergastumisega kõrgema energiaga orbitaalile. Niisiis kujutatakse süsiniku aatomit CH4 tekkimisel üle minemas elektronkonfiguratsiooni
2s1 2px1 2py 2pz1
Kuigi süsiniku aatomi ergastamiseks kulub energiat, eraldub nelja tugevama sideme moodustumisel märgatavalt rohkem energiat. Seega on süsiniku neljavalentne vorm levinum kui kahevalentne.
Hübridisatsioon[muuda | muuda lähteteksti]
Arutelu metaani teemal pole siiski lõppenud. Süsiniku 2p-orbitaalide osalusel peaksid moodustuma kolm σ-sidet üksteise suhtes 90° nurga all ja üks määramata suunaga side s-orbitaali arvel. Kuivõrd p-orbitaalid ulatuvad tuumast kaugemale ja moodustavad tugevama sideme, peaks kolm sidet olema püsivamad ja üks nõrgem. Kõik olemasolevad eksperimentaalsed andmed aga kinnitavad, et metaani neli sidet on võrdse tugevusega ja samaväärselt orienteeritud. Neljavalentse süsiniku sidemete ekvivalentsusega on kooskõlas kvantmehaaniline käsitlus, mis kasutab hübridiseerunud orbitaalide mõistet. Hübridisatsioon on aatomorbitaalide segunemine selle sama aatomi juures ja see toimub tekkivate sidemete suurema tugevuse tagamiseks. Kui süsiniku üks 2s- ja kolm 2p-orbitaali segunevad, tekib neli sp3-hübriidset orbitaali. Iga hübriidorbitaal sisaldab paardumata elektroni, mis saab vesiniku 1s-elektroniga paarduda. Metaani struktuur koosneb siis neljast vesiniku 1s-orbitaalide ja süsiniku sp3-orbitaalide kattumisel tekkinud σ-sidemest. Erinevate orbitaalide segunemisel tekib erinevaid hübriidorbitaale. Süsiniku puhul on olulisemad kolm hübridiseerumise varianti, mida klassikalises keemias nimetatakse valentsolekuteks. Süsiniku esimesele valentsolekule vastab hübridisatsiooniaste sp3, teisele sp2 ja kolmandale sp. Kaksiksidemega süsinik on sp2-hübriidsete orbitaalidega, kolmiksidemega süsinik on sp-hübriidsete orbitaalidega.[5]
Resonants[muuda | muuda lähteteksti]
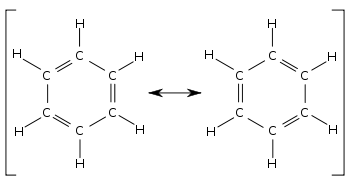
Planaarne heksagonaalne beseeni molekul illustreerib hästi järgnevat VB-teooria osa. Kõik kuus süsinikku on sp2-hübridisatsioonis. Süsiniku kaks sp2-orbitaali on kasutuses σ-sideme moodustamiseks naaberaatomitega, üks sp2-orbitaal annab σ-sideme vesiniku aatomiga. Hübridiseerumata 2p-orbitaal võib anda π-sidemeid kõrvalaatomite 2p-orbitaalidega. Pii-side saab moodustuda kas parempoolse naaberaatomi või vasakpoolse naaberaatomi 2p-orbitaaliga. Igale erinevale paigutusele vastab üks VB-lainefunktsioon. Tegelik lainefunktsioon on nende paigutuste lainefunktsioonide summa (ehk superpositsioon). Resonantsi efekt seisneb selles, et kaksiksideme omadusi jagatakse ühtlaselt üle kogu struktuuri ja igal süsinik-süsinik-sidemel on üheaegselt üksik- ja kaksiksideme omadusi. Resonants alandab märgatavalt süsteemi energiat.[6]
Teooria tänapäeval[muuda | muuda lähteteksti]
Valentssidemete teooria ja molekulaarorbitaalide teooria täiendavad teineteist. Molekulaarorbitaalide teooria (MO-teooria) ei nõustu VB-teooria ideega, et elektronpaarid on lokaliseeritud kahe konkreetse aatomi vahel. Nimelt MO-teooria kohaselt on elektronid jaotunud molekulaarorbitaalide vahel, mis ulatuvad üle kogu molekuli. MO-teooria kaudu saab arvutada molekuli magnetilisi ja ionisatsiooniomadusi lihtsamalt kui VB-teooria kaudu, kuigi tulemused on laias laastus samasugused. Matemaatika, millel valentssidemete teooria põhineb, on MO-teooria omast keerulisem ning keerulisuse tõttu saab VB-teooriat rakendada ainult suhteliselt väikeste molekulide jaoks. Teisest küljest annab VB-teooria parema kirjelduse sideme tekkel või katkemisel toimuvale elektrilaengu ümberjaotumisele keemilises reaktsioonis. VB-teooria ennustab korrektselt homonukleaarsete kaheaatomiliste molekulide dissotsieerumist kaheks eraldiseisvaks aatomiks. Samas MO-teooria järgi peaks dissotsiatsioonil tekkima segu aatomitest ja ioonidest. Mitmed uurimisrühmad on arendanud n-ö tänapäevast valentssidemete teooriat. Põhiline muutus seisneb selles, et aatomorbitaalide kattumine asendub valentsorbitaalide kattumisega. Valentsorbitaalid võivad katta suuremat arvu aatomeid, terve molekuli või ainult ühe aatomi (nagu varasemas VB-teoorias). Sellise lähenemisega arvutatud energiad on juba võrreldavad Hartree-Focki lainefunktsiooni abil (ehk MO-teooria kaudu) saadud tulemustega.
Viited[muuda | muuda lähteteksti]
- ↑ "Valence bond and molecular orbital models". Wired Chemist (inglise). Vaadatud 18.10.2013.
- ↑ "Walter Heitler" (inglise). Originaali arhiivikoopia seisuga 12.11.2012. Vaadatud 18.10.2013.
- ↑ Shaik, Sason S.; Phillipe C. Hiberty (2008). A Chemist's Guide to Valence Bond Theory. New Jersey: Wiley-Interscience. ISBN 978-0-470-03735-5.
- ↑ 4,0 4,1 "Chemical bonding". Encyclopedia Britannica (inglise). Vaadatud 18.10.2013.
- ↑ Talvik, Agu-Tõnis (1996). Orgaaniline keemia. Tartu Ülikooli Kirjastus. ISBN 9985-56-1821.
- ↑ Atkins, Peter; Loretta Jones (2012). Keemia alused. Tartu: Taru Ülikooli Kirjastus. ISBN 9789949321421.
