Glutamiinhape
See artikkel vajab toimetamist. (November 2011) |
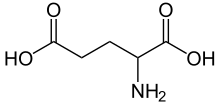
Glutamiinhape (lühend Glu või E, brutovalem C5H9NO4) on toidu- ja organismivalkudes esinev happeline aminohape. Glutamiinhape kuulub asendatavate aminohapete hulka ja on väga polaarne molekul. Glutamiinhape sisaldab veega vesiniksidemeid andvaid funktsionaalrühmi ja on seetõttu vees hästi lahustuv. Glutamiinhapet esineb kahe erisuguse isomeerina. Looduslikult esineb vaid L-isomeer, kuid on olemas ka D-isomeerne glutamiinhape. Glutamiinhappele vastavad koodonid GAA ja GAG.
Glutamiinhappe karboksülaatanioonid (kõrvalahela -COOH on deprotoneeritud, andes COO-) ja soolad (deprotoneeritud kõrvalahelale liidetakse näiteks K+) on tuntud kui glutamaadid.
Glutamaat on oluline neurotransmitter ja kannab tähtsat rolli õppimisel ja mälestuste loomisel.[1] Glutamaati kasutatakse ravimitööstuses ning ka lõhna- ja maitsetugevdajana. Glutamiinhape on oluline suhkrute ja rasvade metabolismis.
Ajalugu[muuda | muuda lähteteksti]
Kuigi glutamiinhapet leidub väga paljudes toiduainetes, avastati selle ja teiste aminohapete roll maitseelamuses teaduslikult alles 20. sajandi alguses. Glutamiinhappe avastas ja identifitseeris 1866. aastal sakslasest keemik Karl Heinrich Leopold Ritthausen. 1907. aastal tuvastas Tōkyō Ülikooli teadur Kikunae Ikeda pärast suure koguse kombu puljongi aurustamist pruunid glutamiinhappe kristallid. Neid proovides tundis ta kirjeldamatut, kuid selgelt eristatavat maitset, mille olemasolu oli ta märganud ka teistes toiduainetes (eriti vetikates). Professor Ikeda nimetas selle maitse umamiks (tõlkes "meeldiv hõrk maitse"). Seejärel patenteeris ta meetodi kristallilise glutamiinhappe soola (naatriumvesinikglutamaat) massiliseks tootmiseks.[2][3]
Keemilised omadused[muuda | muuda lähteteksti]
Kõrvalahela karboksüülhappest funktsionaalrühma pKa on 4,1 ja see esineb negatiivselt laetud deprotoneeritud karboksülaadina ainult pH vahemikus 7,35–7,45 (COO--na).
Glutamiinhappe COOH pKa1 on 2,19, NH3+ pKa2 on 9,67 ja R-rühma pKa3 on 4,25. Glu isoelektrilise punkti (pH, mille juures glutamaadi molekul on neutraalne – molekuli summaarne laeng on 0) väärtus on 3,22.[4]
Biosüntees[muuda | muuda lähteteksti]
| Reagendid | Produktid | Ensüüm |
|---|---|---|
| Glutamiin + H2O | → Glu + NH3 | Glutaminaas, Glutamaat dehüdrogenaas 2 |
| NAcGlu + H2O | → Glu + Atsetaat | (teadmata) |
| α-ketoglutaraat + NADPH + NH4+ | → Glu + NADP+ + H2O | glutamiin dehüdrogenaas 1, glutamiin dehüdrogenaas 2[5] |
| α-ketoglutaraat + α-aminohape | → Glu + α-oksü hape | transaminaas |
| 1-pürroliin-5-karboksülaat + NAD+ + H2O | → Glu + NADH | Aldehüüd dehüdrogenaas |
| N-formimino-L-glutamaat + FH4 | → Glu + 5-formimino-FH4 | Formiminotransferaas tsüklodeaminaas |
| L-alaniin + α-ketoglutaraat | → püruvaat + L-glutamaat [6] | Alaniin transaminaas |
Funktsioonid ja kasutamine[muuda | muuda lähteteksti]
Metabolism[muuda | muuda lähteteksti]
Glutamaat on rakumetabolismi võtmemolekuliks. Inimese organismis lõhustatakse toidus sisalduvad valgud aminohapeteks, mis on metaboolseks kütuseks kehas toimuvatele protsessidele. Aminohapete lagunemise võtmeprotsessiks on transaminatsioon, mille korral aminorühm viiakse aminohappelt α-ketohappele. Tavaliselt viib katalüüsi läbi transaminaas. Reaktsiooni kulgemine:
R1-aminohape + R2-α-ketohape ⇌ R1-α-ketohape + R2-aminohape
Üks tavapärasematest α-ketohapetest on α-ketoglutaraat, mis on tsitraaditsükli vahefaasi ühend. α-ketoglutaraadi transaminatsioon annab glutamaadi. Saadud α-ketohappe produkt on sageli ka väga kasulik ning võib olla substraadiks järgnevates metabolismi protsessides:
Alaniin + α-ketoglutaraat ⇌ püruvaat + glutamaat
Aspartaat + α-ketoglutaraat ⇌ oksaloatsetaat + glutamaat
Nii oksaloatsetaat kui ka püruvaat on rakumetabolismis võtmekomponentideks. Substraatidena või intermediaatidena võtavad nad osa fundamentaalsetest protsessidest nagu näiteks glükolüüsist, glükoneogeneesist ja tsitraaditsükli reaktsioonidest. Glutamaat on oluline ka kehast üleliigse lämmastiku eemaldamiseks. Glutamaat deamineeritakse (ehk tema aminorühm eemaldatakse) ja eraldub ammoonium:
Glutamaat + H2O + NADP+ → α-ketoglutaraat + NADPH + NH3 + H+
Ammoonium eritatakse seejärel valdavalt karbamiidina, mille süntees viiakse läbi maksas.
Glutamiinhappe metabolismi tulemusena võib tekkida ka gamma-aminovõihape (GABA), mis on tuntud aju neuroprotsesside ülekandjate inhibiitorina. Kui GABAt on liiga vähe, siis võib mõnes ajupiirkonnas tekkida üleliigne aktiivsus, mis võib põhjustada haigushooge ja hüperaktiivset käitumist.
Neurotransmitter[muuda | muuda lähteteksti]
 Pikemalt artiklis Glutamaat neurotransmitterina
Pikemalt artiklis Glutamaat neurotransmitterina
Glutamaati on eksitatoorse neurotransmitterina kõige rikkalikumalt selgroogsete närvisüsteemis. Keemilise sünapsi puhul on glutamaat talletatud vesiikulitesse. Glutamaati vabastatakse eelsünapsi rakust läbi närviimpulsside. Vastastikuses sünapsijärgses rakus on glutamaadiretseptorid (näiteks NMDA retseptor), mis seovad vaba glutamaadi ja aktiveeruvad. Oma rolli tõttu sünaptilises plastilisuses seostatakse glutamaati kognitiivsete funktsioonidega (nagu õppimine) ja ka ajumahuga.[7] Glutamaatülekandjaid[8] leidub neuron- ja gliaalmembraanides. Need eemaldavad glutamaadi tõhusalt rakuvälisest ruumist. Peapõrutuse või -vigastuse korral toimivad nad vastupidi ja üleliigsed glutamaadid saavad akumuleeruda väljaspool rakku. See protsess põhjustab kaltsiumioonide sattumist raku sisemusse läbi NMDA retseptorkanalite, mis omakorda tekitab neuroloogilisi kahjustusi ja lõpuks ka rakusurma.
Glutamiinhapet on seostatud epilepsia ehk langetõvega. Kui lisada mikrokogus glutamiinhapet neuronitesse ehk närvirakkudesse, siis tekivad ühe murdsekundi jooksul iseeneslikud depolarisatsioonid ja see sarnaneb väga olukorraga, kui inimesel esineb epilepsiahoog. See on tingitud membraani potentsiaali muutusest, mis tuleneb iseeneslikult aktiveerunud kaltsiumikanalitest ja millele järgneb glutamiinhappe vabanemine ja edasine depolarisatsioon.
Glutamaadi kontsentratsiooni määramiseks tervest rakust kasutatakse eksperimentaalse meetodina geneetiliselt rakendatud nanosensorit.[9] Selles sensoris on ühendatud glutamaati siduv proteiin ja kaks fluorestseeruvat proteiini. Kui glutamaat seondub sensoriga, siis sensori fluorestsents muutub ultravioletse valguse all tänu kahe fluorestseeruva proteiini resonantsile. Nanosensori sisestamine rakku võimaldab glutamaadi kontsentratsiooni optiliselt määrata.
Selgrootutel ja selgroogsetel on glutamaadi retseptorite evolutsiooniline areng erinev, eriti silmas pidades lülijalgseid ja ümarusse, kus glutamaat stimuleerib glutamaatsõltuvaid Cl-kanaleid. Retseptori beeta-allüksused reageerivad glutamaadi ja glütsiiniga suure afiinsusega.[10] Antihelmintilise ravi terapeutiliseks eesmärgiks on nende retseptorite märkimine kasutades avermektiine. Avermektiinid märgivad suure afiinsusega glutamaadisõltuvate Cl-kanalite alfa-allüksusi.[11] Nende retseptorite olemasolu on märgatud samuti lülijalgsetes (nagu näiteks Drosophila melanogaster[12] ja Lepeophtheirus salmonis).[13] Retseptorite pöördumatu aktiveerimine avermektiinidega põhjustab sünapsides ja neuromuskulaarsetes ühenduskohtades hüperpolarisatsiooni, mis omakorda tekitab ümarussidel ja lülijalgsetel lõtva ehk perifeerset halvatust ja lõpuks ka surma.
Tuumamagnetresonantsspektroskoopia (TMR spektroskoopia)[muuda | muuda lähteteksti]
Viimastel aastatel on tuumamagnetresonantsspektroskoopia kasutamist palju uuritud. Dipolaarsete vastastiktoimete ulatuse jälgimiseks kasutatakse tihti glutamiinhappe derivaati, milleks on polü-γ-bensüül-L-glutamaat (PBLG).[14]
Toitaine[muuda | muuda lähteteksti]
Glutamiinhapet leidub loomalihas, linnulihas, kalas, munas ja piimatoodetes ning seda võivad sisaldada ka mõned proteiinirikkamad taimed (näiteks 30–35% nisuproteiinist on glutamiinhape). 95% toidus sisalduvast glutamaadist metaboliseeritakse soolestiku rakkudes.[15]
Lõhna- ja maitsetugevdaja[muuda | muuda lähteteksti]
Väga paljud toiduained sisaldavad vaba glutamiinhapet, kaasa arvatud juust ja sojakaste. Glutamiinhappe sisaldusest tekib umami, mis inimese maitsemeeltes on üks viiest põhilistest maitsest. Glutamiinhappe naatriumsoola, milleks on naatriumvesinikglutamaat (MSG), kasutatakse sageli toidulisandina, lõhna- ja maitsetugevdajana.
Farmakoloogia[muuda | muuda lähteteksti]
Ravim fentsüklidiin (tuntud kui PCP, phencyclidine) antagoniseerib glutamiinhappe NMDA retseptoril mittekonkureerivalt. Samadel põhjustel on üldanesteetikum ketamiinil tugevad dissotsiatiivsed ja hallutsinogeensed toimed. Glutamaat ei läbi hematoentsefaalbarjääri väga kergesti, selle asemel transporditakse seda suure afiinsusega transportsüsteemi abil.[16] Glutamaat võib muunduda ka glutamiiniks.
Viited[muuda | muuda lähteteksti]
- ↑ Robert Sapolsky (2005). "Biology and Human Behavior: The Neurological Origins of Individuality, 2nd edition". The Teaching Company.
see pages 19 and 20 of Guide Book
- ↑ Renton, Alex (10.07.2005). "If MSG is so bad for you, why doesn't everyone in Asia have a headache?". The Guardian. Vaadatud 21.11.2008.
- ↑ "Kikunae Ikeda Sodium Glutamate". Japan Patent Office. 07.10.2002. Originaali arhiivikoopia seisuga 28.10.2007. Vaadatud 21.11.2008.
- ↑ David L. Nelson, Michael M. Cox, Lehninger Principles of Biochemistry fourth edition, 78
- ↑ Grabowska A, Nowicki M, Kwinta J (2011). "Glutamate dehydrogenase of the germinating triticale seeds: gene expression, activity distribution and kinetic characteristics". Acta Phys. Plant. 2011 (5): 1981. DOI:10.1007/s11738-011-0801-1. Originaali arhiivikoopia seisuga 24. september 2019. Vaadatud 3. novembril 2011.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ H. Robert Horton, J.David Rawn, Laurence A. Moran, K. Gray Scrimgeour, Raymond S. Ochs; Principles of Biochemistry third edition, 132
- ↑ McEntee, W. & Crook, T (1993). "Glutamate: its role in learning, memory, and the aging brain". Psychopharmacology. 111 (4): 391–401. DOI:10.1007/BF02253527. PMID 7870979.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Shigeri Y, Seal RP, Shimamoto K (juuli 2004). "Molecular pharmacology of glutamate transporters, EAATs and VGLUTs". Brain Res. Brain Res. Rev. 45 (3): 250–65. DOI:10.1016/j.brainresrev.2004.04.004. PMID 15210307.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Okumoto, S.; et al. (2005). "Detection of glutamate release from neurons by genetically encoded surface-displayed FRET nanosensors". Proceedings of the National Academy of Sciences U.S.A. 102 (24): 8740–8745. DOI:10.1073/pnas.0503274102. PMC 1143584. PMID 15939876.
{{cite journal}}: et al.-i üleliigne kasutus kohas:|author=(juhend) - ↑ Laughton, D.L.; Wheeler, S.V.; Lunt, G.G.; Wolstenholme, A.J. (1995). "The beta-subunit of Caenorhabditis elegans avermectin receptor responds to glycine and is encoded by chromosome 1". J. Neurochem 64 (5): 2354–2357.
- ↑ Cully, D.F.; Vassilatis, D.K.; Liu, K.K.; Paress, P.S.; Van der Ploeg, LHT; Schaeffer, J.M.; Arena, J.P. (1994). "Cloning of an avermectin-sensitive glutamate gated choride channels from Caenorhabditis elegans". Nature 371 (6499): 707–711.
- ↑ Cully, D.F., Paress, P.S., Liu, K.K., Schaeffer, J.M. and Arena, J.P. 1996. "Identification of a Drosophila melanogaster glutamate-gated chloride channel sensitive to the antiparasitic agent avermectin". J. Biol. Chem. '271, 20187-20191'
- ↑ Tribble, N.D.; Burka, J.F.; Kibenge, F.S.B. (2007). "Identification of the genes encoding for putative gamma aminobutyric acid (GABA) and glutamate-gated chloride channel (GluCl) alpha receptor subunits in sea lice (Lepeophtheirus salmonis)". J. Vet. Pharmacol. Ther. 30 (2): 163–167.
- ↑ C. M. Thiele, Concepts Magn. Reson. A, 2007, 30A, 65–80
- ↑ Reeds, P.J.; et al. (1. aprill 2000). "Intestinal glutamate metabolism". Journal of Nutrition. 130 (4s): 978S–982S. PMID 10736365.
{{cite journal}}: et al.-i üleliigne kasutus kohas:|author=(juhend) - ↑ Smith QR (aprill 2000). "Transport of glutamate and other amino acids at the blood-brain barrier". J. Nutr. 130 (4S Suppl): 1016S–22S. PMID 10736373.
Välislingid[muuda | muuda lähteteksti]
| Pildid, videod ja helifailid Commonsis: Glutamiinhape |
