Sekretsioon
| See artikkel räägib elusorganismides aset leidvast protsessist; mõiste kohta geoloogias vaata Sekretsioon (geoloogia). |
Sekretsioon ehk nõristus on keemiliste ainete või nende substraatide viimistlemine ja vabastamine rakust või näärmetest.[1]
Bakterite puhul tähendab sekretsioon efektormolekulide transporti rakkudest väliskeskkonda. Sellisteks molekulideks võivad olla näiteks valgud, ensüümid ja toksiinid. Nii täidab sekretsioon väga tähtsat rolli bakterite elutegevuses, võimaldades neil keskkonnas ellu jääda.
Eukarüootsetes organismides on sekretsioon vajalik kogu organismi talitlemiseks. Sekreete toodetakse inimese kehas näiteks seedetraktis, kopsudes ja rasunäärmetes. Nendes sekreteeritakse organismi palju erinevaid ensüüme, maomahla, rasu ja hormoone, ilma milleta ei suudaks organism talitleda.
Sekretsioon eukarüootsetes rakkudes[muuda | muuda lähteteksti]
Eukarüootsetes rakkudes, ka inimese omades, on sekretsiooniprotsess hästi arenenud. Sünteesitud sekretoorsed valgud suunatakse endoplasmaatilise retiikulumi luumenisse, kus nad glükosüleeritakse ning kus molekulaarsed chaperon'id valgud kokku pakivad. Valesti kokkupakitud valgud viiakse tagasi tsütosooli, kus proteasoomid nad ära lagundavad. Vesiikulid, mis sisaldavad õigesti kokkupakitud valke, sisenevad Golgi kompleksi, kus glükosüleeritud valkude konformatsioon muutub. Golgi kompleksis toimuvad edasised transpordijärgsed muudatused, sealhulgas ka valkude sortimine ja pakkimine. Valgud viiakse seejärel sekretoorsetesse vesiikulitesse, mis liiguvad mööda tsütoskeletti raku perifeeriasse. Sekretoorsetes vesiikulites toimuvad valkudes veel mõned muudatused (näiteks insuliini muutumine proinsuliiniks). Lõpuks ühinevad vesiikulid rakumembraaniga ning valgud viiakse rakust välja.
Eukarüootse sekretsiooni tüübid on autokriinne, parakriinne, endokriinne ja eksokriinne sekretsioon.
Autokriinse sekretsiooni all peetakse silmas selliste ainete nagu kasvufaktorite nõristust, mis mõjutavad sekreteerivat rakku ennast (nii toimib näiteks selgroogsete immuunsüsteemi vastus võõrastele antigeenidele).
Ebanormaalne autokriinne sekretsioon leiab aset näiteks vähirakkudes – vähirakk eritab kasvufaktoreid, millele ta ise reageerib, ja tulemuseks võib olla raku kontrollimatu kasv.
Parakriinse sekretsiooni all peetakse silmas naaberrakke mõjutavate ainete nõristust.
Endokriinne sekretsioon tähendab rakkudevahelist suhtlussüsteemi, kus endokriinrakud nõristavad vereringesse signaalmolekule (hormoone), eksokriinse sekretsiooniga viiakse aineid aga organismist välja või seedekulglasse.[2]
Sekretsioon gramnegatiivsetes bakterites[muuda | muuda lähteteksti]
Sekretsioon ei ole omane ainult eukarüootidele, vaid ka bakteritele ja arhedele. ATP-seostusvalgud (ingl ATP binding cassette, ABC) on iseloomulikud kõigile kolmele domeenile. Üldine sekretsioonimehhanism ehk Sec-süsteem moodustab Sec Y-E-G kompleksi. Sec-translookoni abil viiakse mõned sekreteeritavad valgud läbi tsütoplasmamembraani rakust välja. See mehhanism vajab sekreteeritaval valgul olevat N-terminaalset signaalpeptiidi. Teised valgud viiakse läbi tsütoplasmamembraani twin-arginine translocation pathway ehk Tat-raja abil. Gramnegatiivsetel bakteritel on kaks membraani, mis teeb sekretsioonisüsteemid keeruliseks. Gramnegatiivsetes bakterites on vähemalt kuus erinevat spetsialiseerunud sekretsioonisüsteemi. Paljud sekreteeritud valgud on eriti tähtsad bakterite patogeensuses.[3]
I tüüpi sekretsioonisüsteem (T1SS või TOSS)[muuda | muuda lähteteksti]
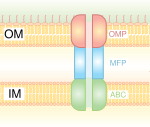 Esimest tüüpi sekretsioonisüsteem sarnaneb ABC-transporteriga, kuid selles on veel mitmeid valke, mis koos ABC-transporteriga moodustavad pideva kanali. Need kanalid läbivad gramnegatiivse bakteri sisemise ja välimise membraani. See on lihtne süsteem, mis koosneb vaid kolmest alaühikust: välismembraanis paiknevast kanalist (ingl outer membrane protein, OMP), sisemembraanil paiknevast ABC-transporterist ja periplasmas paiknevast valgust (ingl membrane fusion protein, MFP). Esimest tüüpi sekretsioonisüsteem transpordib mitmeid molekule, nii ioone kui ka erinevas suuruses valke (20–900 kDa), samuti näiteks ravimeid. Molekulid, mida sekreteeritakse, võivad olla väga erinevas suuruses. Näiteks Escherichia coli valk kolitsiin V on vaid 10 kDa suurune, Pseudomonas fluorescens'i proteiin Lap A on aga 900 kDa suurune. Kõige paremini on kirjeldatud RTX-toksiinide ja lipaaside sekretsiooni. I tüüpi sekretsioonisüsteem ekspordib ka mittevalgulisi substraate, näiteks tsüklilisi β-glükaane ja polüsahhariide.[4]
Esimest tüüpi sekretsioonisüsteem sarnaneb ABC-transporteriga, kuid selles on veel mitmeid valke, mis koos ABC-transporteriga moodustavad pideva kanali. Need kanalid läbivad gramnegatiivse bakteri sisemise ja välimise membraani. See on lihtne süsteem, mis koosneb vaid kolmest alaühikust: välismembraanis paiknevast kanalist (ingl outer membrane protein, OMP), sisemembraanil paiknevast ABC-transporterist ja periplasmas paiknevast valgust (ingl membrane fusion protein, MFP). Esimest tüüpi sekretsioonisüsteem transpordib mitmeid molekule, nii ioone kui ka erinevas suuruses valke (20–900 kDa), samuti näiteks ravimeid. Molekulid, mida sekreteeritakse, võivad olla väga erinevas suuruses. Näiteks Escherichia coli valk kolitsiin V on vaid 10 kDa suurune, Pseudomonas fluorescens'i proteiin Lap A on aga 900 kDa suurune. Kõige paremini on kirjeldatud RTX-toksiinide ja lipaaside sekretsiooni. I tüüpi sekretsioonisüsteem ekspordib ka mittevalgulisi substraate, näiteks tsüklilisi β-glükaane ja polüsahhariide.[4]

II tüüpi sekretsioonisüsteem (T2SS)[muuda | muuda lähteteksti]
Seda süsteemi võib nimetada ka Sec-sõltuva sekretsiooniraja põhiharuks. Valk transporditakse periplasmasse üldise sekretsiooni kaudu, kuid see, kuidas valk periplasmast väljub, sõltub sekretiinvalkudest, mis asuvad välismembraanil. Periplasmast lähevad valgud läbi välimise membraani multimeerse (12–14 alaühikut) kompleksi kaudu, kus valke täiendatakse. Lisaks sekretsiooniproteiinidele on kogu sekretsioonisüsteemis veel 10–15 sisemise ja välimise membraani proteiini, millest paljude kindel funktsioon on teadmata. Teist tüüpi sekretsioonisüsteemi kaudu saab rakust välja saata toksiine, seda sekretsiooniteed kasutab näiteks Vibrio cholerae koolera toksiini transpordiks. Teist tüüpi sekretsioonisüsteem on eriline selle poolest, et see süsteem viib rakust välja juba eelnevalt periplasmas kokkupakitud valgud.[4]
III tüüpi sekretsioonisüsteem (T3SS)[muuda | muuda lähteteksti]
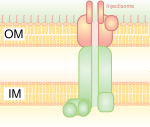 Kolmandat tüüpi sekretsioonisüsteem meenutab molekulaarset süstalt, millega bakterid (nt mõned Salmonella, Shigella, Yersinia ja Vibrio liigid) saavad valke eukarüootsetesse rakkudesse süstida. Madal Ca2+-kontsentratsioon tsütosoolis avab värava, mis reguleerib III tüüpi sekretsioonisüsteemi. Üks mehhanism, mis tuvastab madalat kaltsiumikontsentratsiooni, on IcrV (Low Calcium Response) antigeen Yersinia pestis'es, mis tingib T3SS-i kinnitumise rakule. Seda sekretsioonisüsteemi kasutavad tavaliselt patogeenid toksiinide või aktiivsete valkude transpordiks peremeesrakku.[4]
Kolmandat tüüpi sekretsioonisüsteem meenutab molekulaarset süstalt, millega bakterid (nt mõned Salmonella, Shigella, Yersinia ja Vibrio liigid) saavad valke eukarüootsetesse rakkudesse süstida. Madal Ca2+-kontsentratsioon tsütosoolis avab värava, mis reguleerib III tüüpi sekretsioonisüsteemi. Üks mehhanism, mis tuvastab madalat kaltsiumikontsentratsiooni, on IcrV (Low Calcium Response) antigeen Yersinia pestis'es, mis tingib T3SS-i kinnitumise rakule. Seda sekretsioonisüsteemi kasutavad tavaliselt patogeenid toksiinide või aktiivsete valkude transpordiks peremeesrakku.[4]
IV tüüpi sekretsioonisüsteem (T4SS)[muuda | muuda lähteteksti]
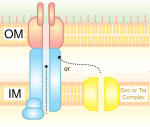
IV sekretsioonisüsteem on sarnane bakterite konjugatsioonisüsteemiga. See transpordib nii DNA-d kui ka valke ühest rakust teise. T4SS avastati Agrobacterium tumefaciens'is, kes kasutab seda süsteemi oma DNA viimiseks taimerakku, mis omakorda põhjustab kasvaja tekkimist. Helicobacter pylori kasutab seda sekretsioonisüsteemi CagA-valgu transpordiks mao epiteelirakkudesse.[5] Neljandat tüüpi sekretsioonisüsteemi täpne mehhanism on veel teadmata. T4SS on gramnegatiivsetes bakterites kodeeritud konjugatsiooni elemendina. T4SS on 11–13 valgust koosnev kanal, mille kaudu saavad DNA ja proteiinid minna doonorraku tsütoplasmast retsipientrakku.[6]
V tüüpi sekretsioonisüsteem (T5SS)[muuda | muuda lähteteksti]
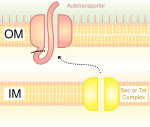 T5SS kutsutakse ka autotransportersüsteemiks.[7] Nagu II tüüpi sekretsioonisüsteem, kasutavad ka siin valgud Sec-sõltuvat süsteemi, et liikuda läbi sisemembraani, misjärel eemaldatakse N-terminaalne signaaljärjestus. Teatud ekstratsellulaarsed valgud vahendavad iseenda transporti läbi välismembraani. Periplasmasse jõudes seonduvad need valgud välismembraanile ja moodustavad iseenda jaoks poorid. Valgu C-terminusel on võime moodustada poore, mis lasevad väliskeskkonda jõuda ülejäänud valgul, mis lõigatakse moodustunud poori küljest lahti. Kõige tavalisem näide autotransporteritest, mis kasutavad seda sekretsioonisüsteemi, on trimeersed autotransporteri adhesiinid (ingl trimeric autotransporter adhesins).[8]
T5SS kutsutakse ka autotransportersüsteemiks.[7] Nagu II tüüpi sekretsioonisüsteem, kasutavad ka siin valgud Sec-sõltuvat süsteemi, et liikuda läbi sisemembraani, misjärel eemaldatakse N-terminaalne signaaljärjestus. Teatud ekstratsellulaarsed valgud vahendavad iseenda transporti läbi välismembraani. Periplasmasse jõudes seonduvad need valgud välismembraanile ja moodustavad iseenda jaoks poorid. Valgu C-terminusel on võime moodustada poore, mis lasevad väliskeskkonda jõuda ülejäänud valgul, mis lõigatakse moodustunud poori küljest lahti. Kõige tavalisem näide autotransporteritest, mis kasutavad seda sekretsioonisüsteemi, on trimeersed autotransporteri adhesiinid (ingl trimeric autotransporter adhesins).[8]
VI tüüpi sekretsioonisüsteem (T6SS)[muuda | muuda lähteteksti]
VI tüüpi sekretsioonisüsteem avastati kahes patogeenses bakteris Vibrio cholerae's ja Pseudomonas aeruginosa's 2006. aastal.[9][10] Sellest ajast on VI tüüpi sekretsioonisüsteemi leitud neljandikus kõikidest proteobakteriaalsetest genoomidest, sealhulgas loomade, taimede ja inimeste patogeenidest, ka mulla- ja merebakteritest.[11][12] Varasemad uuringud T6SS kohta olid keskendunud selle patogeensele rollile kõrgemates organismides. Nüüd on näidatud, et T6SS-il on roll ka bakterite kaitses lihtsamate eukarüootide vastu ja mikroobidevahelise suhtlusvahendina.[13][14] Kuuendat tüüpi sekretsioonisüsteemi geeniklastrid sisaldavad 15–20 geeni. Selle sekretsioonisüsteemi valgud on struktuurianalüüsil väga sarnased T4-faagi sabaga ja ka süsteemi toimemehhanism sarnaneb faagi nakatumisviisiga.[15]
Sekretsioon grampositiivsetes bakterites[muuda | muuda lähteteksti]
Valgud, millel on N-terminaalne signaal, vabanevad pärast sünteesi tsütoplasmasse ja suunatakse seejärel otse spetsiifilisele transpordirajale. Samal ajal kui valk liigub läbi tsütoplasmaatilise membraani või vahetult pärast seda valk töödeldakse ja volditakse kokku selle aktiivsesse vormi. Enne sekreteerimist võidakse valku hoiustada tsütoplasmas. Signaalpeptiid, mis viib valgu membraanile, määrab transpordiraja spetsiifilisuse. Signaalpeptiide klassifitseeritakse vastavalt transpordirajale, kuhu nad valke suunavad. Enamik eksporditud valke viiakse tsütoplasmast periplasmasse üldise sekretsioonimehhanismi ehk sec-sõltuva mehhanismi vahendusel. Kõige tuntumatel virulentsusfaktoritel, mida sekreteerivad grampositiivsed bakterid, on tüüpiline N-terminaalne signaalpeptiid, mis võimaldab neid valke viia üldisesse sekretsioonimehhanismi. Valgud, mida transporditakse mööda sec-süsteemi, viiakse läbi tsütoplasmamembraani voltimata kujul. Nende modifitseerimine ja kokkuvoltimine toimub rakuseinas.[3]
Viited[muuda | muuda lähteteksti]
- ↑ Lee, Jin-Sook; Jeremic, Aleksandar; Shin, Leah; Cho, Won Jin; Chen, Xuequn; Jena, Bhanu P. (2012). "Neuronal porosome proteome: Molecular dynamics and architecture". Journal of Proteomics. 75 (13): 3952–62. DOI:10.1016/j.jprot.2012.05.017. PMID 22659300.
- ↑ Arvo Tuvikene, Hormonaalne kontroll, veebiversioon (vaadatud 3.07.2014)
- ↑ 3,0 3,1 Wooldridge, K, toim (2009). Bacterial Secreted Proteins: Secretory Mechanisms and Role in Pathogenesis. Caister Academic Press. ISBN 978-1-904455-42-4.
- ↑ 4,0 4,1 4,2 Salyers, A. A. & Whitt, D. D. (2002). Bacterial Pathogenesis: A Molecular Approach, 2nd ed., Washington, D.C.: ASM Press. ISBN 1-55581-171-X
- ↑ Hatakeyama, Masanori; Higashi, Hideaki (2005). "Helicobacter pylori CagA: A new paradigm for bacterial carcinogenesis". Cancer Science. 96 (12): 835–43. DOI:10.1111/j.1349-7006.2005.00130.x. PMID 16367902.
- ↑ Lawley, T.D; Klimke, W.A; Gubbins, M.J; Frost, L.S (2003). "F factor conjugation is a true type IV secretion system". FEMS Microbiology Letters. 224 (1): 1–15. DOI:10.1016/S0378-1097(03)00430-0. PMID 12855161.
- ↑ Thanassi, David G.; Stathopoulos, Christos; Karkal, Aarthi; Li, Huilin (2005). "Protein secretion in the absence of ATP: The autotransporter, two-partner secretion and chaperone/usher pathways of Gram-negative bacteria (Review)". Molecular Membrane Biology. 22 (1–2): 63–72. DOI:10.1080/09687860500063290. PMID 16092525.
- ↑ Gerlach, R; Hensel, M (2007). "Protein secretion systems and adhesins: The molecular armory of Gram-negative pathogens". International Journal of Medical Microbiology. 297 (6): 401–15. DOI:10.1016/j.ijmm.2007.03.017. PMID 17482513.
- ↑ Pukatzki, Stefan; Ma, Amy T.; Sturtevant, Derek; Krastins, Bryan; Sarracino, David; Nelson, William C.; Heidelberg, John F.; Mekalanos, John J. (2006). "Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system". Proceedings of the National Academy of Sciences. 103 (5): 1528–33. Bibcode:2006PNAS..103.1528P. DOI:10.1073/pnas.0510322103. JSTOR 30048406. PMC 1345711. PMID 16432199.
- ↑ Mougous, Joseph D.; Cuff, Marianne E.; Raunser, Stefan; Shen, Aimee; Zhou, Min; Gifford, Casey A.; Goodman, Andrew L.; Joachimiak, Grazyna; Ordoñez, Claudia L. (2006). "A Virulence Locus of Pseudomonas aeruginosa Encodes a Protein Secretion Apparatus". Science. 312 (5779): 1526–30. Bibcode:2006Sci...312.1526M. DOI:10.1126/science.1128393. PMC 2800167. PMID 16763151.
- ↑ Bingle, Lewis EH; Bailey, Christopher M; Pallen, Mark J (2008). "Type VI secretion: A beginner's guide". Current Opinion in Microbiology. 11 (1): 3–8. DOI:10.1016/j.mib.2008.01.006. PMID 18289922.
- ↑ Cascales, Eric (2008). "The type VI secretion toolkit". EMBO reports. 9 (8): 735–41. DOI:10.1038/embor.2008.131. PMC 2515208. PMID 18617888.
- ↑ Schwarz, Sandra; Hood, Rachel D.; Mougous, Joseph D. (2010). "What is type VI secretion doing in all those bugs?". Trends in Microbiology. 18 (12): 531–7. DOI:10.1016/j.tim.2010.09.001. PMC 2991376. PMID 20961764.
- ↑ Coulthurst, S. (2013). "The type VI secretion system – A widespread and versatile cell targeting system". Research in Microbiology. DOI:10.1016/j.resmic.2013.03.017. PMID 23542428.
- ↑ Silverman, J.; Brunet, Y.; Cascales, E. P.; Mougous, J. (2012). "Structure and Regulation of the Type VI Secretion System". Annual Review of Microbiology. 66: 453–472. DOI:10.1146/annurev-micro-121809-151619. PMC 3595004. PMID 22746332.
Kirjandus[muuda | muuda lähteteksti]
- Lynn E Heasley, Autocrine and paracrine signaling through neuropeptide receptors in human cancer, 26. märts 2001, 20. kd, nr 13, lk 1563–1569, veebiversioon (vaadatud 3.07.2014) (inglise keeles)
