Ensüümiinhibiitor

Ensüümiinhibiitor on molekul, mis seob ennast ensüümiga ja vähendab selle aktiivsust. Kuna see on võimeline tapma patogeeni või korrigeerima metaboolset tasakaalu, siis põhinevad paljud ravimid ensüümiinhibiitoritel. Neid kasutatakse ka herbitsiidide ja pestitsiididena. Kõik molekulid, mis ennast ensüümiga seovad, ei ole ensüümiinhibiitorid: ensüümaktivaatorid näiteks seovad ensüümiga, aga hoopis tõstavad selle aktiivsust.
Inhibiitori sidumine võib takistada substraadi sisenemist aktiivtsentrisse, ensüümil reaktsiooni katalüüsi või mõlemat korraga. Inhibiitori sidumine võib olla pöörduv või pöördumatu. Pöördumatud inhibiitorid muudavad harilikult ensüümiga reageerides seda keemiliselt. Need inhibiitorid muudavad harilikult tähtsaid aminohappejääke, mis on vajalikud ensüümaktiivsuse tagamiseks. Pöörduvad inhibiitorid seovad ennast aga mittekovalentselt ja toimub erinevaid tüüpe inhibeerimisi, sõltuvalt sellest, kas inhibiitor seob ensüümiga, ensüüm-substraat kompleksiga või mõlemaga.
Paljude ravimite molekulid on ensüümiinhibiitorid. Seetõttu on nende avastamine ja arendamine enamasti seotud bioorgaaniliste ja farmakoloogiliste uurimustega. Meditsiinilist inhibiitorit hinnatakse enamasti tema spetsiifilisuse (võime siduda ennast ainult kindla valguga) ja aktiivsuse (inhibiitori dissotsiatsioonikonstant, mis viitab ensüümi inhibeerimiseks vajalikule inhibiitori kontsentratsioonile) järgi. Inhibiitori kõrge spetsiifilisus ja aktiivsus kindlustavad, et ravimil on vähe kõrvalnähte ja seetõttu ka madal toksilisus.[1]
Pöörduvad inhibiitorid
[muuda | muuda lähteteksti]Pöörduvate inhibiitorite tüübid
[muuda | muuda lähteteksti]Pöörduvad inhibiitorid seovad ennast ensüümiga nõrkade interaktsioonide kaudu, nagu näiteks vesinikside ja hüdrofoobne interaktsioon. Palju nõrku aktiivtsentri ja inhibiitori vahelisi sidemeid moodustavad tugeva ja spetsiifilise seostumise. Erinevalt substraadist ja mittepöörduvast inhibiitorist ei reageeri pöörduv inhibiitor ensüümiga seostumisel keemiliselt ning on seetõttu lihtsalt eemaldatav kas lahjendamise või dialüüsi abil.

On olemas nelja tüüpi pöörduvaid inhibiitoreid, mille aluseks on võetud ensüümi substraadi varieerimise mõju inhibiitorile.[2]
- Konkureeriva inhibeerimise puhul ei saa substraat ja inhibiitor samaaegselt ensüümiga seotud olla. See on puhkudel, kus inhibiitor omab afiinsust ensüümi aktiivtsentris, kuhu seostub ka substraat, mis tähendab, et mõlemad konkureerivad ensüümi aktiivtsentrisse pääsu pärast. Sellist inhibeerimist võib pärssida piisavas hulgas substraadi lisamisega, kuna Vmax jääb konstantseks. Konkureerivad inhibiitorid on tihti substraadiga sarnase struktuuriga.
- Ebakonkureerival inhibeerimisel (mitte ajada sassi mittekonkureeriva inhibeerimisega) seostub inhibiitor ainult substraat-ensüüm kompleksiga. Sellist tüüpi inhibeerimine toob kaasa Vmax-i (maksimumkiirus väheneb aktiivse kompleksi kadumise tõttu) vähenemise, aga Km-le mõju ei avalda, kuna ei häiri substraadi sidumist.
- Segainhibeerimisel võib inhibiitor seostuda ensüümiga samaaegselt kui substraat, aga tema seostumine mõjutab substraadi sidumist ja vastupidi. Seda tüüpi inhibeerimist ei ole võimalik tagasi lükata, aga saab vähendada substraadi kontsentratsiooni suurendamisega. Kuigi segatüüpi inhibiitorid võivad seostuda ka aktiivtsentriga, siis omab inhibeerimine harilikult allosteerilist efekt, mille puhul seob inhibiitor ennast ensüümi mõne teise piirkonnaga. Inhibiitori seostumisel allosteerilise piirkonnaga muutub ensüümi konformatsioon, mille tulemusel väheneb aktiivtsentrisse seostunud substraadi afiinsus.
- Mittekonkureeriv inhibeerimine on üks segainhibeerimise liike, mille puhul inhibiitori ensüümiga seostumine mõjutab ensüümi aktiivsust, aga ei mõjuta substraadi sidumist. Selle tulemusel sõltub inhibeerimise ulatus ainult inhibiitori kontsentratsioonist. Inhibeerimise käigus Vmax väheneb, kuna reaktsioonivõime efektiivsus langeb, Km jääb aga samaks, kuna Km-i väärtust sõltub substraadi sidumisest , see aga inhibeerimise käigus ei muutu.
Pöörduva inhibeerimise kvantitatiivne kirjeldus
[muuda | muuda lähteteksti]Kvantitatiivselt võib pöörduvat inhibeerimist kirjeldada kui inhibiitori sidumist ensüümi või ensüüm-kompleksiga ning selle mõju ensüümi kineetilistele konstantidele. Klassikalise Michaelis-Menteni skeemi põhjal seob ensüüm (E) ennast substraadiga (S), et moodustada ensüüm-substraat kompleksi (ES). Katalüüsi toimel vabaneb reaktsioonist produkt (P) ja vaba ensüüm. Inhibiitor (I) võib ennast siduda kas E või ES-ga vastavate dissotsiatsioonikonstantide Ki või Ki' alusel.
- Konkureerivad inhibiitorid võivad siduda E-ga aga mitte ES-ga. Konkureeriv inhibeerimine tõstab Km-i väärtust (inhibiitor sekkub substraadi seostumisse), aga samas ei mõjuta see Vmax väärtust (inhibiitor ei mõjuta ES-i katalüüsi, kuna ei ole võimeline ES-ga seostuma).
- Mittekonkureerivad inhibiitorid omavad E ja ES suhtes üpris sarnast afiinsust (Ki = Ki'). Mittekonkureeriv inhibeerimine ei mõjuta Km (ei mõjuta substraadi sidumist), aga vähendab Vmax (inhibiitori sidumine takistab katalüüsi).
- Segatüüpi inhibiitorid seostuvad nii E kui ka ES-ga, aga nende afiinsused kummagi suhtes on erinevad (Ki ≠ Ki'). Seega segavad segatüüpi inhibiitorid substraadi sidumist (vähendavad Km) ja takistavad ES kompleksi katalüüsi (vähendavad Vmax).

Kui ensüümil on mitu substraati, siis võib ilmneda erinevat tüüpi inhibeerimist sõltuvalt sellest, millist substraati inhibeeritakse. See ilmneb juhul, kui ensüümi aktiivtsentris on kaks sidumispiirkonda kahele erinevale substraadile. Näiteks võib inhibiitor võib olla konkurentne esimesse piirkonda siduva substraadiga A, aga olla samas ka mittekonkureeriv substraadiga B, mis seob teise piirkonda.[3]
Pöörduva inhibiitori dissotsiatsioonikonstandi mõõtmine
[muuda | muuda lähteteksti]Nagu ülalpool mainitud, on ensüümiinhibiitor iseloomustatud kahe dissotsiatsioonikonstandi (Ki ensüümi ja Ki' ensüüm-substraat kompleksi puhul) põhjal. Ensüüm-inhibiitor konstanti Ki on võimalik otseselt mõõta mitmel erineval viisil. Üheks väga täpseks meetodiks on isotermiline kulonomeetriline tiitrimine, mille puhul inhibiitoriga tiitritakse ensüümi lahust ja mõõdetakse eraldunud või neeldunud soojushulk.[4] Ki' väärtuse mõõtmine aga nõnda lihtne ei ole, kuna ensüüm-substraat kompleksi eluiga on lühike ja see on keemiline reaktsioon produkti saamiseks. Seetõttu ongi Ki' enamasti mõõdetud kaudselt, jälgides ensüümi aktiivsust erinevatel inhibiitori ja substraadi kontsentratsioonidel ning seejärel sobitades andmed muudetud Michaelis-Menteni valemisse[5].
Antud valemis on Km substraadi sidumiskonstant, Vmax sidumise algkiirus ja [S] substraadi kontsentratsioon ja modifikatsioonifaktorid α ja α' on defineeritud inhibiitori kontsentratsiooni ja kahe dissotsiatsioonikonstandi alusel.
Ki ja Ki' tähistavad inhibiitori sidumise konstante.
Erijuhtumid
[muuda | muuda lähteteksti]- Osaliselt konkureeriv inhibeerimine on sarnane mittekonkureeriva inhibeerimisega, välja arvatud see, et EIS omab katalüütilist aktiivsust, mis võib olla kas suurem või väiksem kui ES kompleksi oma. Selle inhibeerimise puhul harilikult Vmax väheneb, aga Km jääb muutumatuks.[6]
- Substraadi ja produkti inhibeerimise käigus üks neist kahest inhibeerib ensüümi aktiivsust. Taoline inhibeerimine võib minna kas konkureeriva, ebakonkureeriva või segainhibeerimise rada mööda. Substraadi inhibeerimise puhul esineb kõrgel substraadi kontsentratsiooni juures aktiivsuse langus. See võib esineda kahe sidumispiirkonnaga ensüümidel, mil madalal kontsentratsioonil on seotud kõrgema afiinsusega piirkond ja kineetika kulgeb normaalselt. Kõrge kontsentratsiooni puhul aga seotakse ka teine piirkond, mis toob kaasa ensüümi inhibeerimise.[7] Produkti inhibeerimine on tihti regulatoorne iseärasus ainevahetuses ja võib olla negatiivse tagasiside vorm.
- Aeglane-tihe inhibeerimine esineb juhul, kui algses ensüüm-inhibiitor kompleksis (EI) toimub isomerisatsioon ja tekib tihedamalt hoidev kompleks, aga üleüldine inhibeerimise protsess on ikkagi pöörduv. See toimib kui aeglaselt tõusev ensüümi inhibeerimine. Taolistes tingimustes annab Michaelis-Menteni võrrand vale Ki väärtuse, kuna protsess on ajast sõltuv. Õiget Ki väärtust on võimalik saada läbi keerulisema analüüsi.
Pöörduvate inhibiitorite näiteid
[muuda | muuda lähteteksti]
Kuna ensüümid on arenenud nõnda, et nende side substraadiga oleks tugev ja pöörduvad inhibiitorid seovad enamasti ensüümi aktiivtsentrisse, siis pole väga üllatav, et paljud neist inhibiitoritest on väga sarnased sihtmärkidele suunatud substraatidega. Üheks taoliseks substraadi struktuuri matkivaks näiteks on proteaasi inhibiitorid, mis on väga edukas klass retroviirusevastaseid ravimeid, millega raviti HI-viirust.[8] Ritonaviiri, peptiidsel ehitusel põhineva proteaasi inhibiitori, struktuur on näha paremal. Kuna see ravim sarnaneb HIV proteaasi substraadiga, konkureerib inhibiitor ensüümi aktiivtsentrisse sidumisel substraadi endaga.
Tihti on inhibiitorid disainitud jäljendama ensüüm-katalüüsitud reaktsioonide aktiveeritud olekut ja vaheolekut. See näitab ära, et inhibiitor kasutab ära ensüümi aktiveeritud oleku stabiliseerituse efekti, mille tulemusel paraneb sidumise afiinsus (madalam Ki) võrreldes substraadi-tüüpi inhibiitoritega. Üks näide sellistest aktiveeritud oleku inhibiitoritest on viirusevastane ravim oseltamiviir, mis matkib tasapinnalist oksooniumiooni olemust reaktsioonis viraalse ensüümi neuraminidaasiga.[9]

Kõik inhibiitorid aga ei põhine substraadi struktuuridel. Näiteks ühe teise HIV proteaasi inhibiitori, tipranaviiri, struktuur on näidatud vasakul. See molekul ei baseeru peptiidsel ehitusel ega oma ka ilmseid sarnasusi substraadiga. Taolised mittepeptiidsed inhibiitorid võivad olla stabiilsemad kui peptiidsidemega inhibiitorid, kuna nad pole substraadid peptitaasile.[10]
Ravimi disaini juures on tähtis arvestada substraadi kontsentratsiooni, millele ensüüm on avatud. Näiteks on olemas proteiinkinaasi inhibiitoreid, mis sarnanevad struktuurilt adenosiintrifosfaadiga (inglise keeles adenosine triphosphate – ATP), mis on ka ensüümi üheks substraadiks. Sel juhul peavad inhibiitorid, mis on lihtsalt konkureerivad, võistlema ATP kõrge kontsentratsiooniga rakus. Proteiinkinaase võib inhibeerida ka inhibiitoriga, mis konkureerib kinaasi peptiidsubstraadi sidumispiirkonnaga, kuna enamiku taoliste peptiidi kontsentratsioon rakus on palju väiksem kui ATP oma. Kui on kaks sarnase afiinsusega proteiinkinaasi inhibiitorit, millest vaid üks konkureerib ATP-ga, teine aga ensüümi peptiidi siduva piirkonnaga, siis inhibeeritakse ensüümi palju efektiivsemalt.[11]
Pöördumatud inhibiitorid
[muuda | muuda lähteteksti]Pöördumatute inhibiitorite tüübid
[muuda | muuda lähteteksti]
Tavaliselt modifitseerivad pöördumatud inhibiitorit kovalentselt, nii et inhibeerimist ei ole võimalik tagasi lükata. Taolised inhibiitorid sisaldavad tihti reaktiivsed funktsionaalrühmi, nagu näiteks aldehüüde, haloalkaane, Michaeli reagente, fenüülsulfonaate või fluorofosfonaate. Need elektrofiilsed rühmad reageerivad aminohapete kõrvalahelatega, moodustades kovalentseid ühendeid. Modifitseeruvad ühendid tekivad aminohapetega, mis sisaldavad nukleofiile, nagu hüdroksüül- ja tioolrühmasid. Sellisteks aminohapeteks on näiteks seriin, tsüsteiin, treoriin või türosiin.[12]
Pöördumatu inhibeerimine on erinev pöördumatust ensüümi deaktiveerumisest. Pöördumatud inhibiitorid on harilikult selektiivsed ühe klassi ensüümide suhtes ega deaktiveeri kõiki valke. Samuti ei funktsioneeri nad kui valkude struktuuride lõhkujad, vaid inhibiitorid muudavad spetsiifiliselt oma sihtmärgi aktiivtsentrit. Näiteks pH ja temperatuuri ekstreemumid põhjustavad harilikult kõikide valkude struktuuride denaturatsiooni, aga see efekt pole selektiivne. Samuti on mitteselektiivseid keemilisi töötlemisi, mis hävitavad valkude struktuuri. Näiteks valkude kuumutamine vesinikkloriidhappes hüdrolüüsib peptiidsidemed, mis hoiavad valke koos ja lagundab valgu vabadeks aminohapeteks.[13]
Pöördumatud inhibiitorid näitavad ajast sõltuvat inhibeerimist ja nende potentsiaali ei saa seetõttu kirjeldada IC50-ga. Põhjuseks on, et aktiivse ensüümi hulk kindla kontsentratsiooniga pöördumatu inhibiitori juuresolekul sõltub sellest, kui kaua on ensüümi ja inhibiitori segu eelinkubeeritud. Selle asemel kasutatakse väärtust kobs/[I][14], kus kobs on näilik esimese astme inaktivatsiooni määr ja [I] on inhibiitori kontsentratsioon. Liige kobs/[I] on kasutatav seni, kuni inhibiitor ei küllastu ensüümiga sidumisel (sel juhul kobs=kinact).
Pöördumatute inhibiitorite kineetika
[muuda | muuda lähteteksti]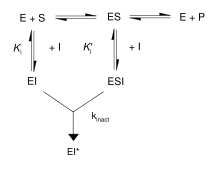
Nagu skeemil on näha, moodustavad pöördumatud inhibiitorid ensüümiga mittekovalentse pöörduva kompleksi (EI ja ESI), mis järgnevalt reageerivad, luues kovalentselt seotud "tupiku" kompleksi EI*. See määr, mil EI* moodustub, on deaktivatsiooni määr ehk kinact. Kuna EI moodustamine võib konkureerida ES tekkimisega, saab pöördumatu inhibiitori seostumist ennetada konkureerides kas substraadi või teise, pöörduva inhibiitoriga. Taoline kaitse on hea tõestus pöördumatu inhibiitori selektiivsele reaktsioonile ensüümi aktiivtsentriga.[15]
Erijuhtumid
[muuda | muuda lähteteksti]
Kõik pöördumatud inhibiitorid ei moodusta kovalentseid ühendeid oma sihtmärgiliste ensüümidega. Mõned pöörduvad inhibiitorid seostuvad ensüümiga nii tihedalt, et nad on põhimõtteliselt pöördumatud. Need tihedalt seostuvad inhibiitorid võivad toimida sarnase kineetika alusel kui pöördumatud inhibiitorid. Sel juhul seovad mõned nendest inhibiitoritest ennast kiirelt ensüümi madala afiinsusega EI kompleksi külge ja läbivad siis aeglase ümberkorralduse tihedalt seotud EI* kompleksiks. Sellist kineetilist käitumist nimetatakse aeglaseks sidumiseks.[17] Taoline aeglane ümberkorraldus pärast sidumist toob tihti kaasa konformatsioonimuutuse, kui ensüüm justkui klammerduks ümber inhibiitori molekuli. Taoliste aeglaste sidumiste näiteks võib tuua mõned üpris tähtsad ravimid, nagu allopurinool[18] ja atsükloviiri aktiveeritud vorm[19].
Pöördumatute inhibiitorite näited
[muuda | muuda lähteteksti]
"Enesetapu" inhibeerimine on üks pöördumatu inhibeerimise ebatavaline vorm, mille käigus ensüüm muudab inhibiitori oma aktiivtsentris reaktiivseks. Näiteks võib tuua polüamiidide biosünteesi inhibiitori, α-difluorometüülornitiini (DFMO), mis on aminohappe ornitiini, millega ravitakse ka unitõve (African trypanosomniasis), analoog. Ornitiini dekarboksülaas võib katalüüsida ornitiini asemel DFMO dekarboksüleerimist, nagu näidatud ülemisel pildil. Siiski järgneb dekarboksüleerimisele fluoriaatomi eemaldamine, mis muudab katalüütlise vaheoleku konjunkeeritud imiiniks. See reaktiivne DFMO vorm reageerib siis kas tsüsteiini või lüsiini jäägiga ensüümi aktiivtsentris, mis deaktiveerib ensüümi pöördumatult.[16]
Kuna pöördumatu inhibeerimine eeldab tihti mittekovalentse EI kompleksi moodustamist, on vahel võimalik, et inhibiitor seostub ensüümiga mitut erinevat moodi. Näiteks nagu pildilt näha, on ühe inimese ainurakse parasiidi Trypanosoma cruz'i reduktaasi inhibeerib aktiivtsentris kaks molekuli. Ülemine molekul on seotud pöörduvalt, aga alumine on moodustanud aktiivtsentris olevate aminohappe kõrvalrühmadega kovalentse sideme.[20]
Inhibiitorite avastamine ja disainimine
[muuda | muuda lähteteksti]Uued ravimid on pika ravimiarenduse tulemus, mille esimeseks sammuks on uue inhibiitori avastamine. Vanasti oli uute inhibiitorite avastamine võimalik vaid katseeksituse meetodil: suure hulga ühendite katsetamine ühe kindla ensüümi juures, ainult lootes, et kuskilt tuleb mõni juhtlõng, millest kinni haarata. Taoline metoodika on tegelikult kasutusel ka tänapäeval, aga seda on täiendatud kombineeritud keemia lähenemisviisidega, mis lubavad valmistada suurel hulgal uusi ühendeid ning mõõtmisel kasutatakse kõrgefektiivset katsetamist, mis sorteerib välja kasulikud inhibiitorid.[21]
Alles hiljuti on hakatud kasutama alternatiivsemat metoodikat: ratsionaalset ravimi disaini, mis kasutab ensüümide kolmemõõtmelist struktuuri ennustamaks, millised ühendid võiksid olla inhibiitorid.[22] Potentsiaalselt sobivad ühendid analüüsitakse täiendavalt ja nõnda võivad sündida uued ning piisava selektiivsusega inhibiitorid. Kui uus ja piisavalt selektiivne ühend on sünteesitud, uuritakse selle sidumist aktiivtsentrisse. See annab teadmisi, et viia läbi muudatusi ja optimeerida seostumist. Sellist testimist ja parandamist viiakse läbi seni, kuni tõhus inhibiitor on valmis.[23] Arvutitel põhinevad meetodid(molekulaarmehaanika), mis suudavad ennetada inhibiitori afiinsust ensüümi suhtes, on veel arendamisjärgus.
Inhibiitorite kasutamine
[muuda | muuda lähteteksti]Ensüümiinhibiitoreid leidub looduses ning neid disainitakse ja valmistatakse ka bioorgaanilises keemias ja farmakoloogias. Paljud looduslikud mürgid on tihti ensüümiinhibiitorid, mis on välja arendatud selleks, et kaitsta taime või looma kiskjate eest. Need looduslikud toksiinid on ühed kõige mürgisemad teadaolevad ühendid. Tehislikult valmistatud inhibiitoreid kasutatakse tihti ravimitena, kuid neid leidub ka putukamürkides (malatioon), taimemürkides (glüfosaat) või desinfitseerijates (triklosaan).
Ainevahetuse kontroll
[muuda | muuda lähteteksti]Ensüümiinhibiitoritel on roll ka ainevahetuses. Mitmeid rakus olevaid metaboolseid radasid inhibeerivad metaboliidid, mis kontrollivad ensüümi aktiivsust allosteerilise regulatsiooni või substraadi inhibeerimise kaudu. Heaks näiteks on glükolüüsi allosteeriline regulatsioon. Selle katabolismi raja käigus tarbitakse ära glükoos ja sellest saadakse ATP, NADH ja püroviinamarihape. Glükolüüsi regulatsiooni üks võtmeetappe on raja varajane reaktsioon, mida katalüüsib fosfofruktokinaas (PFK1). Kui ATP tase tõuseb, seostub ta PFK1 allosteerilise piirkonnaga ja vähendab ensüümi reaktsiooni määra: glükolüüs on inhibeeritud ja ATP tootmine langeb. See negatiivse tagasiside kontroll aitab säilitada ATP stabiilset taset rakus. Siiski pole metabolismi rajad reguleeritud ainult inhibitsiooniga, sest ensüümi aktivatsioon on samuti tähtis. FPK1-ga seoses on fruktoos-2,6-bifosfaat ja ADP näiteks metaboliidid, mis on seotud allosteerilise aktivatsiooniga.[24]
Ka füsioloogilised ensüümiinhibeerimised võivad olla seotud spetsiifiliste valgu inhibiitoritega. Selline mehhanism võib esineda pankreases, mis sünteesib mitmeid seedimise prekursori ensüüme, mida nimetatakse tsümogeenideks. Paljusid neist aktiveerib trüpsiin proteaas, nii et on oluline inhibeerida trüpsiini aktiivsust pankreases, et vältida organi enda ära seedimist.[25] Trüpsiini aktiivsust on võimalik kontrollida, kui valmistada kõhunäärmes selektiivset trüpsiini inhibiitorvalku. See inhibiitor seob ennast tihedalt trüpsiiniga, ennetades trüpsiini liigset aktiivsust, mis oleks kahjulik organile endale. Kuigi trüpsiini inhibiitor on valk, väldib ta hüdrolüüsumist kui substraat, väljastades vett trüpsiini aktiivtsentrisse ja destabiliseerides aktiviseeritud olekut.[26] Teiseks näiteks võib tuua proteiin fosfataasi inhibiitorid.[27]
Putuka- ja taimemürgid
[muuda | muuda lähteteksti]Paljud putuka- ja taimemürgid on samuti ensüümiinhibiitorid. Atsetüülkoliinesteraas (AChE) on ensüüm, mida on leitud putukatest kuni inimesteni. AChE on hädavajalik, et tagada närvirakkude normaalne toimimine, mille käigus lagundatakse neurotransmitter atsetüülkoliin algosadeks, atsetaadiks ja koliiniks. Selline tegevus on neurotransmitterite ,nagu serotoniini, dopamiini ja norepinefriini hulgas üpris unikaalne, kuna enamik neist imenduvad, mitte ei lagune. Suurt hulka AChE inhibiitoreid kasutatakse nii meditsiinis kui ka põllumajanduses. Pöörduvaid konkureerivaid inhibiitoreid, nagu edrofooniumi, füsostimiini ja neostigmiini kasutatakse müasteenia ravis ning narkoosis. Karbamaadi pestitsiidid on samuti näited pöörduvatest AChE inhibiitoritest. Organofosfaatidega kahjurimürgid, nagu näiteks malatioon, paratioon ja kloropürifoss on pöördumatud atsetüülkoliini inhibiitorid.
Taimemürgid, nagu sulfonüülureaas inhibeerivad ensüümi atsetoolatsetaat süntaasi. Seda ensüümi on vaja taimedel hargnenud ahelatega aminohapete valmistamiseks. Veel paljusid ensüüme inhibeerivad taimemürgid, kaasa arvatud ensüüme, mida on vaja lipiidide ja karotenoidide biosünteesiks ning protsessideks, nagu fotosüntees ja oksüdatiivset fosforüülimine.[28]
Samuti on paljud inhibiitorid kasutusel mitte ainult mürkidena, vaid ka loomade ja taimede kaitsevahendina. Nad kasutavad neid inhibiitoreid kaitseks neid ohustavate kiskjate vastu.
Viited
[muuda | muuda lähteteksti]- ↑ Shapiro, R; Vallee, BL (1991). "Interaction of human placental ribonuclease with placental ribonuclease inhibitor". Biochemistry. 30 (8): 2246–55. DOI:10.1021/bi00222a030. PMID 1998683.
- ↑ Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company ISBN 0-7167-4955-6
- ↑ Irwin H. Segel, Enzyme Kinetics : Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems. Wiley–Interscience; New edition (1993), ISBN 0-471-30309-7
- ↑ Holdgate, GA (2001). "Making cool drugs hot: isothermal titration calorimetry as a tool to study binding energetics". BioTechniques. 31 (1): 164–6, 168, 170 passim. PMID 11464510.
- ↑ Leatherbarrow, RJ (1990). "Using linear and non-linear regression to fit biochemical data". Trends in biochemical sciences. 15 (12): 455–8. DOI:10.1016/0968-0004(90)90295-M. PMID 2077683.
- ↑ Irwin H. Segel, Enzyme Kinetics : Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems. Wiley-Interscience; New Ed edition (1993), ISBN 0-471-30309-7
- ↑ Dixon, M. Webb, E.C., Thorne, C.J.R. and Tipton K.F., Enzymes (3rd edition) Longman, London (1979) p. 126
- ↑ Hsu, JT; Wang, HC; Chen, GW; Shih, SR (2006). "Antiviral drug discovery targeting to viral proteases". Current pharmaceutical design. 12 (11): 1301–14. DOI:10.2174/138161206776361110. PMID 16611117.
- ↑ Lew W, Chen X, Kim CU (2000). "Discovery and development of GS 4104 (oseltamivir): an orally active influenza neuraminidase inhibitor". Curr. Med. Chem. 7 (6): 663–72. PMID 10702632.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Fischer PM (2003). "The design, synthesis and application of stereochemical and directional peptide isomers: a critical review". Curr. Protein Pept. Sci. 4 (5): 339–56. DOI:10.2174/1389203033487054. PMID 14529528.
- ↑ Bogoyevitch, MA; Barr, RK; Ketterman, AJ (2005). "Peptide inhibitors of protein kinases-discovery, characterisation and use". Biochimica et Biophysica Acta. 1754 (1–2): 79–99. DOI:10.1016/j.bbapap.2005.07.025. PMID 16182621.
- ↑ Lundblad R. L. Chemical Reagents for Protein Modification CRC Press Inc (2004) ISBN 0-8493-1983-8
- ↑ N. Price, B. Hames, D. Rickwood (Ed.) Proteins LabFax Academic Press (1996) ISBN 0-12-564710-7
- ↑ Adam, GC; Cravatt, BF; Sorensen, EJ (2001). "Profiling the specific reactivity of the proteome with non-directed activity-based probes". Chemistry & biology. 8 (1): 81–95. DOI:10.1016/S1074-5521(00)90060-7. PMID 11182321.
- ↑ Maurer, T; Fung, HL (2000). "Comparison of methods for analyzing kinetic data from mechanism-based enzyme inactivation: application to nitric oxide synthase". AAPS pharmSci. 2 (1): E8. PMC 2751003. PMID 11741224.
- ↑ 16,0 16,1 Poulin, R; Lu, L; Ackermann, B; Bey, P; Pegg, AE (1992). "Mechanism of the irreversible inactivation of mouse ornithine decarboxylase by alpha-difluoromethylornithine. Characterization of sequences at the inhibitor and coenzyme binding sites". The Journal of biological chemistry. 267 (1): 150–8. PMID 1730582.
- ↑ Szedlacsek, SE; Duggleby, RG (1995). "Kinetics of slow and tight-binding inhibitors". Methods in enzymology. 249: 144–80. DOI:10.1016/0076-6879(95)49034-5. PMID 7791610.
- ↑ Pick, FM; McGartoll, MA; Bray, RC (1971). "Reaction of formaldehyde and of methanol with xanthine oxidase". European journal of biochemistry / FEBS. 18 (1): 65–72. DOI:10.1111/j.1432-1033.1971.tb01215.x. PMID 4322209.
- ↑ Reardon, JE (1989). "Herpes simplex virus type 1 and human DNA polymerase interactions with 2'-deoxyguanosine 5'-triphosphate analogues. Kinetics of incorporation into DNA and induction of inhibition". The Journal of biological chemistry. 264 (32): 19039–44. PMID 2553730.
- ↑ Saravanamuthu, A; Vickers, TJ; Bond, CS; Peterson, MR; Hunter, WN; Fairlamb, AH (2004). "Two interacting binding sites for quinacrine derivatives in the active site of trypanothione reductase: a template for drug design". The Journal of biological chemistry. 279 (28): 29493–500. DOI:10.1074/jbc.M403187200. PMID 15102853.
- ↑ Koppitz M, Eis K (2006). "Automated medicinal chemistry". Drug Discov. Today. 11 (11–12): 561–8. DOI:10.1016/j.drudis.2006.04.005. PMID 16713909.
- ↑ Scapin G (2006). "Structural biology and drug discovery". Curr. Pharm. Des. 12 (17): 2087–97. DOI:10.2174/138161206777585201. PMID 16796557.
- ↑ Gohlke H, Klebe G (august 2002). "Approaches to the description and prediction of the binding affinity of small-molecule ligands to macromolecular receptors". Angew. Chem. Int. Ed. Engl. 41 (15): 2644–76. DOI:10.1002/1521-3773(20020802)41:15<2644::AID-ANIE2644>3.0.CO;2-O. PMID 12203463.
- ↑ Okar, DA; Lange, AJ (1999). "Fructose-2,6-bisphosphate and control of carbohydrate metabolism in eukaryotes". BioFactors (Oxford, England). 10 (1): 1–14. DOI:10.1002/biof.5520100101. PMID 10475585.
- ↑ Nicholas Price, Lewis Stevens, Fundamentals of Enzymology, Oxford University Press, (1999) ISBN 0-19-850229-X
- ↑ Smyth, TP (2004). "Substrate variants versus transition state analogues as noncovalent reversible enzyme inhibitors". Bioorganic & medicinal chemistry. 12 (15): 4081–8. DOI:10.1016/j.bmc.2004.05.041. PMID 15246086.
- ↑ Oliver, CJ; Shenolikar, S (1998). "Physiologic importance of protein phosphatase inhibitors". Frontiers in bioscience : a journal and virtual library. 3: D961–72. PMID 9727084.
- ↑ Duke SO (1990). "Overview of herbicide mechanisms of action". Environ. Health Perspect. Brogan &. 87: 263–71. DOI:10.2307/3431034. JSTOR 3431034. PMC 1567841. PMID 1980104.
Välislingid
[muuda | muuda lähteteksti]- Web tutorial on enzyme inhibition, Dr Peter Birchi loeng koos animatsioonidega
- Symbolism and Terminology in Enzyme Kinetics, NC-IUB ensüümiinhibitsiooni terminoloogia soovitused
- PubChem from NCBI, ravimite ja ensüümiinhibiitorite andmebaas
- BRENDA, ensüümide erinevate inhibiitorite andmebaas
- Enzymes, Kinetics and Diagnostic Use, veebiloeng, mis keskendub ensüümiinhibiitorite meditsiinilistele väljundutele: Dr. Michael W. King Indiana Ülikooli meditsiiniosakonnast
- BindingDB, proteiinligandide sidumisafiinsuse avalik andmebaas
- Enzyme Inhibition Animated Exercise (õpetus + testid)

![{\displaystyle V={\frac {V_{max}[S]}{\alpha K_{m}+\alpha ^{\prime }[S]}}={\frac {(1/\alpha ^{\prime })V_{max}[S]}{(\alpha /\alpha ^{\prime })K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a8f0a9dda1d308de7f090f99c2833f944f11a09)
![{\displaystyle \alpha =1+{\frac {[I]}{K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/57fcf54938a9784f9313437681b220079ff43ee5)
![{\displaystyle \alpha ^{\prime }=1+{\frac {[I]}{K_{i}^{\prime }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b7d75a61e059ecea4053a1c7afb91f9cf39a2ab)