Elektrofüsioloogia
Elektrofüsioloogia on teadus, mis uurib rakkude ja kudede elektrilisi omadusi, mõõtes ja mõjutades pinget ja elektrivoolu nii üksiku raku skaalal kui ka tervetes elundites. Neuroloogia osas tegeleb elektrofüsioloogia neuronite elektrilise aktiivsuse jälgimisega.
Peamised elektrofüsioloogia mõõtemeetodid[muuda | muuda lähteteksti]
Elektrofüsioloogia on füsioloogia haru, mis hõlmab laias laastus ioonide liikumist kudedes ja mõõtevahendeid, mida ioonide jälgimiseks kasutatakse. Klassikalise elektrofüsioloogia meetodid seisnevad elektroodide paigutamisega erinevatesse bioloogilisest kudedest preparaatidesse. Põhilised elektroodide tüübid on:
- lihtsad tahked juhid, näiteks kettad ja nõelad (nii üksikelementidena kui ka kobaratena),
- trükkplaadirajad, millel kõik muu peale mõõteteraviku on elektriliselt isoleeritud,
- õõnsad torukesed, mis on täidetud elektrolüüdiga, näiteks klaasist pipetid, milles on kaaliumkloriidi lahus või midagi analoogset.
Peamisteks uurimisobjektideks on:
- elusorganismid,
- värsked koed või koekultuurid,
- eemaldatud kudedest pärinevad üksikud rakud,
- kunstlikult loodud rakud või koed,
- eelmainitute kombinatsioonid.
Kui mõõteelektrood on piisavalt väikese diameetriga (mikromeetri suurusjärgus), saab mõõta ka üksiku raku siseselt, võimaldades rakusisest elektrilist aktiivsust vahetult jälgida. Samas vähendab selline mõõtemeetod raku eluiga ja põhjustab rakumembraani lekkimist. Rakusisest aktiivsust saab jälgida ka klaasist pipeti abil, mis sisaldab elektrolüüdilahust. Mikroskoopilise pipeti ots surutakse rakumembraani vastu, kuhu see klaasi ja rakumembraani lipiidide vahelise interaktsiooni tõttu tugevalt kinnitub. Tekitades pipetis alarõhu, rebestatakse pipeti sisediameetri jagu rakumembraani, viies pipetis oleva elektrolüütlahuse kokku raku sisuga. See meetod muudab raku keemilist koostist. Teine võimalus on kasutada pipeti elektrolüüdilahuses poore moodustavaid aineid, mis augustavad rakumembraani. Tekkinud mikropoorid moodustavad rakumembraani ja väliskeskkonna vahel ioonilise ühenduse, ent suuremolekulaarne elektrolüüdilahus ei pääse läbi pooride ja raku keemiline koostis jääb suhteliselt muutumatuks.
Jättes mõõteelektroodi rakkudevahelisse ruumi, saab üksikraku aktsioonipotentsiaali mõõta ka kaudselt – seda mõõteviisi nimetatakse üksikraku mõõtmiseks (ingl single-unit recording). Elektroodi asetusest ja prepareerimisest olenevalt võib rakuväliselt jälgida ka mitme lähestikku asuva raku aktiivsust korraga. Sellist meetodit nimetatakse mitme raku mõõtmiseks (ingl multi-unit recording).
Mõõteelektroodide suurenedes väheneb mõõtetulemuste lahutusvõime. Suuremad elektroodid on võimelised mõõtma ainult mitme raku summaarset aktiivsust ehk lokaalse kogumi potentsiaali. Veel suuremad kliinilise ja kirurgilise neurofüsioloogia vallas kasutatavad elektroodid, näiteks isoleerimata nõelad ja pinnaelektroodid, on tundlikud ainult teatud tüüpi rakupopulatsioonide sünkroonsele aktiivsusele.
Optilise elektrofüsioloogia meetodid[muuda | muuda lähteteksti]
Optilise elektrofüsioloogia peamiseks eesmärgiks on klassikaliste meetodite piirangute ületamine. Klassikaliste meetoditega saab elektrilist aktiivsust vaadelda ühes koepunktis. Seega ei erista klassikalised mõõtemeetodid rakukogumile iseloomulikku hajutatud elektrilist aktiivsust ühe raku piires toimuvatest paiksetest nähtustest. Huvi bioelektrilise aktiivsuse ruumilise paiknemise vastu viis valgust kiirgavate molekulide väljaarendamiseni, mis reageerivad elektrilistele või keemilistele keskkonnatingimustele. Selliseid aineid võib koesse viia perfusiooni, süstimise või geeniekspressiooni teel ja need võimaldavad elektrilise aktiivsuse jaotust jälgida ühe- või kahemõõtmeliselt.
Rakuväline mõõtmine[muuda | muuda lähteteksti]
Rakumembraani elektrilist aktiivsust saab jälgida klaasist mikropipettide või elektroodide abil ka väljaspool rakku.[1] Erinevalt rakusisesest mõõtmisest, mille puhul mõõteelektrood läbistab rakumembraani, mõjutab rakuväline mõõtmine rakku tunduvalt vähem, ühtlasi saab selle meetodiga teha mõõtmisi mitmes punktis korraga, kasutades mitme elektroodiga kiipe (MEK).[2] Rakuvälise mõõtemeetodi korral kasutatavate elektroodide suurus on umbes 5–10 mikromeetrit. Suhteliselt suured mõõtmed tagavad mõistliku takistuse elektroodi ja elektrolüüdilahuse piiril ning hea signaali ja müra suhte aktsioonipotentsiaalide tuvastamisel. MEK-e kasutatakse mitmes uurimisvaldkonnas, näiteks kultiveeritud neuronivõrgustike dünaamika ja elektrilise aktiivsuse uurimisel[3] ja neuraalse aktiivsuse uurimisel ajus.[4] Samas muudab MEK-ide suurus ja sellest tulenev halb lahutusvõime rakkudest väiksemate struktuuride, näiteks aksonite ja dendriitide mõõtmise keeruliseks.[5] Ühtlasi on MEK-ide suuruse tõttu keeruline seostada üksüheselt konkreetse raku tekitatud signaali ja sellele rakule kõige lähemal paiknevat elektroodi, kuna elektroodid kipuvad mõõtma mitme naabruses oleva raku aktiivsust. Seetõttu on hiljem kindla raku signaalide identifitseerimiseks vaja keerulist järeltöötlust.[6]
MEK-ide suurusest tingitud probleemidele pakuvad lahenduse nanomõõtmetes seadmed. Signaalide registreerimiseks kasutatakse enamasti väljatransistore, mille kanalid on keemiliselt sünteesitud pooljuhist nanojuhtmed (ingl SiNW FET – Silicone NanoWire Field Effect Transistor). Asetades SiNW FET-i huvipakkuvasse elektrofüsioloogilisse keskkonda, muudab seadme nanojuhtmest kanal oma juhtivust vastavalt välisele potentsiaalile. Kuna väljatransistorid on pingega juhitavad, pole elektroodi ja elektrolüüdilahuse vaheline takistus SiNW FET tehnoloogiat kasutades enam probleemiks, seega saavad seadmed olla väga väikesed.[6][7]
Üksikraku mõõtemeetod[muuda | muuda lähteteksti]
Elusorganismi koesse sisestatud elektrood tuvastab enamasti mitme elektroodi otsa läheduses paiknevate rakkude summaarset elektrilist aktiivsust. Kui aga elektroodiks on umbes 1 mikromeetri suuruse otsaga mikroelektrood, siis pärineb detekteeritav signaal tõenäoliselt ühest rakust. Sellist mõõtemeetodit nimetatakse üksikraku mõõtmiseks (ingl single-unit recording). Nii mõõdetud aktsioonipotentsiaalid on väga sarnased rakusisese mõõtemeetodiga saadud tulemustega, kuid signaalitugevus on tunduvalt nõrgem (harilikult umbes 1 mV). Rakuvälist üksikraku mõõtmist kasutatakse peamiselt elavate loomade neuronite aktiivsuse mõõtmisel, andes olulist teavet sellest, kuidas aju töötleb informatsiooni.[8]
Mitme raku mõõtemeetod[muuda | muuda lähteteksti]
Kui elektroodi ots on veidi suurem, siis võib informatsioon pärineda +rakust. Seda meetodit nimetatakse mitme raku mõõtmiseks (ingl multi-unit recording) ja seda kasutatakse peamiselt teadvusel loomade üksikute ajuosade aktiivsuse monitoorimisel normaalse talitluse korral. Mitme seesuguse kõrvuti asetatud elektroodiga saab hinnata ümberkaudsete rakkude arvu ja signaalipiikide päritolu. Üldiselt on suure elektroodiga võimalik jälgida ainult rakukogumi summaarset aktiivsust, mitte üksikuid rakke.
Rakuväline mõõtmine SiNW FET-ide abil[muuda | muuda lähteteksti]
Nanojuhtmetel põhinev väljatransistor (SiNW FET), nagu ka tavaline väljatransistor, koosneb pooljuhtkanalist, lättest, neelust ja paisuelektroodidest, mis on kasvatatud ühisele aluspinnale (peamiselt räni). Läte ja neel on omavahel ühendatud läbi pooljuhtmaterjalist kanali ning paisuga moduleeritakse elektrivälja muutuste kaudu kanali juhtivust. SiNW FET-i nanojuhtmest kanalit kasutatakse 6, mis muudab oma juhtivust paisu suhtes vastavalt välistele mõjudele kanali pinnal.[9]
Kuna SiNW FET põhineb peamiselt ränil, siis annab see suure eelise teiste mõõtemeetodite ees, kuna räni juhtivust on legeerides suhteliselt lihtne muuta. Enamik SiNW FET-i laengukandjatest asub õhukesel pindmisel kihil, muutes seadme ülimalt tundlikuks väliste muutuste suhtes. Seega saab seadmega mõõta väga väikseid välise elektrivälja muutusi.
Rakuväline mõõtmine EOS FET-ide abil[muuda | muuda lähteteksti]
Tavalistes metall-oksiid-pooljuht väljatransistorides tekib madalsageduslik müra peamiselt elektronide tunneliefekti tõttu paisu oksiidis olevatest laengulõksudest. Müra saab vähendada, kui transistori kanal paigutada ränist substraadi sisse (n-ö ära matta).[10] Seda põhimõtet kasutatakse müra vähendamiseks ka EOS-transistorides neuronite jälgimise jaoks. Epitaksiaalselt kasvatatud transistoride neelud, ühine läte ja suurem osa ränist kaetakse metalliga ning transistori kiip ühendatakse juhtmetega keraamilise pakendi külge.[11]
Neuroni ja transistori sidestamiseks kinnitatakse neuron väljatransistori paisu külge elektrolüüt-oksiid-pooljuhiga (EOP, ingl electrolyte-oxide-semiconductor ehk EOS). Rakuvälise potentsiaali muutus elektrolüüdis (raku ja transistori vaheline ala) mõjutab otseselt transistori lätte ja neelu vahelist voolu. Et transistori moduleeriks üksik neuron, kasvatatakse neuronid kiibile võimalikult hõredalt ja kasvuperioodiks on umbes 7–12 päeva. Sellistes tingimustes ei teki tihedaid neuronite ja neuriitide kihte ega Schwanni rakke. Niisuguse sidestamise puhul ei saa aga jälgida terviklike kudede aktiivsust, kuna meetod eeldab koest proovitükkide võtmist ja nende edasi kasvatamist.[11]
Transistori väljundsignaali amplituud on seotud raku ja paisu asendiga. Transistor reageerib raku ja kiibi vahelisele pingele, mida põhjustab neuroni ergastus.[12] Ergastusest tekkinud iooniline vool tekitab raku ja kiibi vahelises alas pingelangu, mille maksimaalne amplituud on raku ja transistori ühenduse keskel ning väheneb servades.
Transistor-nõelkiip[muuda | muuda lähteteksti]
Transistor-nõelkiibid (TNK) on seadmed, mis koosnevad mitmest elektroodist, mille otsa on tavaliselt ühendatud EOS-väljatransistorid. TNK eeliseks on asjaolu, et sellega saab jälgida ajukudede aktiivsust ja signaalimustreid ilma kude isendist eraldamata.[13]
Planaarne selektiivne isolatsioon[muuda | muuda lähteteksti]
Planaarne selektiivne isolatsioon on uus tehnoloogia, mis arendati välja juhtudeks, kus on oluline hea mõõteläbilaskevõime.[14] Selle asemel, et kinnitada rakk mikroskoopilise pipeti külge, asetatakse rakk kiibile, mis sisaldab väikest ava. Üksik rakk asetatakse ava peale ja ava kaudu tekitatakse imu, mille tõttu rakk kinnitub tihedalt ava külge.
 |
 |
Rakusisene mõõtmine[muuda | muuda lähteteksti]
Rakusisene mõõtmine kujutab endast pinge ja/või voolu mõõtmist läbi rakumembraani. Et raku membraanipotentsiaali mõõta, viiakse väike terav mikroelektrood läbi rakumembraani. Puhkeolekus on terve raku membraanipotentsiaal umbes −60 kuni −80 mV, kuid aktsioonipotentsiaali jooksul võib membraanipotentsiaal ulatuda kuni +40 mV. 1963. aastal võitsid Alan Lloyd Hodgkin ja Andrew Fielding Huxley Nobeli meditsiiniauhinna neuroni aktsioonipotentsiaali tekkemehhanismide kirjeldamise eest. Nad mõõtsid eksperimentaalselt Atlandi kalmaari (Loligo pealei) aksoneid rakusiseselt ning nende katsed olid üheks esimeseks rakenduseks pingekinnistuse (ingl voltage-clamp) meetodile. Tänapäeval on rakusisesel mõõtmisel levinumateks mikroelektroodideks klaasist mikropipetid, mille otsa läbimõõt on alla ühe mikromeetri ja takistus mõne megaoomi suurusjärgus. Mikropipetid on täidetud lahusega, millel on rakusisese vedeliku omaga sarnane iooniline koostis. Pipett sisaldab ka kloriiditud hõbedast juhet, mis ühendab elektrolüüdilahuse elektriliselt võimendi ja signaalitöötlusseadmega. Elektroodi vahendusel mõõdetud pinget võrreldakse võrdluselektroodiga, mis asub väljaspool rakku ja on ühenduses rakuvälise vedelikuga. Mida väiksem on elektroodi ots, seda suurem on selle elektriline takistus, seega tuleb elektroodi valimisel teha kompromiss suuruse ja takistuse vahel. Mida suurem on elektrood, seda suuremaid kahjustusi tekitatakse rakule, samas on väikese elektroodi korral termilist müra raskem eristada neuroni signaalidest.
Pingekinnistuse meetod[muuda | muuda lähteteksti]

Pingekinnistuse meetod seisneb raku membraanipotentsiaali fikseerimises kindlas väärtuses. Nii saab mõõta rakumembraani läbivat ioonilist voolu selle membraanipotentsiaali väärtuse puhul.
Membraanipotentsiaali võimendi mõõdab membraani pinget ja saadab tulemuse tagasisidevõimendisse. Tagasisidevõimendi lahutab mõõdetud membraanipinge katse läbiviija seatud pingest, mis pärineb signaaligeneraatorist. Saadud pingete vahe põhjal tuvastatakse membraanipotentsiaali erinevus seatud väärtusest ja vastavalt korrigeeritud vool suunatakse rakku tagasi, et minimeerida viga.
See mõõtemeetod on tähtis selle poolest, et neuroni membraani ioonikanalid on pingest sõltuvad, mis tähendab, et nad avanevad ainult siis, kui membraanipotentsiaal on teatud väärtuste piires.[15]
Selektiivse isolatsiooni meetod[muuda | muuda lähteteksti]
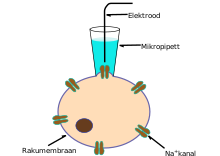
Selle meetodi töötasid välja Erwin Neher ja Bert Sakmann, kes said selle eest ka Nobeli auhinna.[16] Tavaliselt tähendab rakusisene mõõtmine rakumembraani läbistamist peene elektroodiga, kuid selektiivse isolatsiooni meetod on teistsuguse lähenemisega.
Selektiivse isolatsiooni puhul on mikroelektroodiks suhteliselt suure otsadiameetriga mikropipett. Mikropipett asetatakse raku lähedusse ja läbi pipeti tekitatakse kerge imu, eesmärgiga imeda rakumembraan pipeti otsa. Elektroodi klaasist ots moodustab membraaniga tiheda ühenduse. Sellist mõõtmisasendit nimetatakse kinnitatud seisundiks (ingl cell-attached mode), nii saab uurida pipetiga piiritletud membraanitükis paiknevate ioonikanalite aktiivsust. Kui aga tekitada läbi pipeti suurem tõmme, siis võib elektroodi otsas paiknev membraanitükk paigast liikuda, säilitades siiski elektroodi ja raku vahelise ühenduse. Selline täieliku ühenduse seisund (ingl whole-cell mode) tagab väga stabiilsed tingimused rakusiseseks mõõtmiseks. Võrreldes näiteks membraani läbistavate elektroodidega mõõtmisega on täieliku ühenduse seisundi halvaks küljeks asjaolu, et pipetis olev elektrolüüdilahus seguneb rakusisese vedelikuga ning mõne tähtsa rakusisese vedeliku komponendi sisaldus võib väheneda. Alternatiiv täieliku ühenduse meetodile on tekitada membraani sisse nii pisikesed poorid, et erinevalt ioonidest ei pääse suured molekulid neist läbi.[15]
BIT FET meetod[muuda | muuda lähteteksti]
Nii nagu selektiivse isolatsiooni meetodi puhul, saab ka rakusiseseid mõõtmisi teha nanomõõtmetes torude abil. Üks võimalus on kasutada BIT-transistore (BIT – Branched Intracellular nanoTube). BIT-väljatransistoride (BIT FET) puhul on väljatransistori külge kasvatatud nanomõõtmetes ränidioksiidist toru, mis sisestatakse rakku, et juhtida rakus paiknev tsütosool väljatransistorini, täpsemalt ränist tehtud nanojuhtmest kanalini. Nii saab transistori abiga mõõta raku membraanipotentsiaali. Kuna elektrivool praktiliselt puudub ja mõõdetavaks parameetriks on pinge, siis tavaliste mõõtemeetodite, nagu pinge kinnistamise ja selektiivse isolatsiooni meetodi puhul elektroodi mõõtude vähenedes esinev takistuse suurenemine ei ole BIT FET-i puhul probleemiks. Seetõttu saab nanotoru sisediameeter olla väga väike, isegi umbes 3-nanomeetrise diameetri puhul võib saavutada suure mõõtmissageduse ja aktsepteeritava signaali-müra suhte. Ühtlasi mõjutab BIT FET meetod raku struktuuri tunduvalt vähem kui teised, suuremõõtmelised meetodid. Kui nanotoru modifitseerida fosfolipiididega, läbistab nanotoru raku spontaanselt, moodustades tiheda ühenduse ja võimaldades head mõõtetingimused.[17]
Neuroelektroonika[muuda | muuda lähteteksti]
Neuroelektroonika on teadusala, mis tegeleb närvisüsteemi ja elektroonika vaheliste seoste loomise ja uurimisega. Selles keerulises interdistsiplinaarses alas on ühendatud arvutiteadus, tunnetusteadus, neurokirurgia ja biomeditsiin. Neuroelektroonika võib laias laastus jagada kolmeks valdkonnaks:
- neuropilditehnika;
- aju ja arvuti ühendamine;
- neuronite elektriline stimuleerimine.
Viited[muuda | muuda lähteteksti]
- ↑ Cohen, A.; Shappir, J.; Yitzchaik, S.; Spira, M. E. "Reversible transition of extracellular field potential recordings to intracellular recordings of action potentials generated by neurons grown on transistors". Biosensors & Bioelectronics. 23 (6): 811–819.
- ↑ Reppel, M.; Pillekamp, F.; Lu, Z. J.; Halbach, M.; Brockmeier, K.; Fleischmann, K.; Hescheler, J. "Microelectrode arrays: a new tool to measure embryonic heart activity". Journal of Electrocardiology. 37: 104–109.
- ↑ Wagenaar, D. A.; Pine, J.; Potter, S. M. "An extremely rich repertoire of bursting patterns during the development of cortical cultures". BMC Neuroscience. 7 (7): 11.
- ↑ Egert, U.; Heck, D.; Aertsen, A. "Two-dimensional monitoring of spiking networks in acute brain slices". Experimental Brain Research. 142 (2): 268–274.
- ↑ Scanziani, M.; Häusser, M. "Electrophysiology in the age of light". Nature. 461: 930–939.
- ↑ 6,0 6,1 X. Duan,Tian-Ming Fu, Jia Liu, C. M. Lieber, "Nanoelectronics-biology frontier: From nanoscopic probes for action potential recording in live cells to three-dimensional cyborg tissues," Nano Today (2013) 8, 351–373.
- ↑ S.M. Sze, K.K. Ng, Physics of Semiconductor Devices, 3rd ed., Wiley Interscience, New York, 2006.
- ↑ Boulton, A. A. (1990). Neurophysiological techniques: applications to neural systems. Clifton, NJ: Humana Press.
- ↑ Li, B. – R., C. – C. Chen, Rajesh U. Kumar, and Y. – T. Chen. "Advances in nanowire transistors for biological analysis and cellular investigation." Analyst (2014)
- ↑ M. Fadlallah, G. Ghibaudo, J. Jomaah, G. Gu_gan, Solid-State Electron. 2003, 47, 1155–1160.
- ↑ 11,0 11,1 M. Voelker, P Fromherz, "Signal Transmission from Individual Mammalian Nerve Cell to Field-Effect Transistor", 2005 Wiley-VCH Verlag GmbH &Co.
- ↑ Fromherz, P. "Extracellular recording with transistors and the distribution of ionic conductances in a cell membrane". European Biophysics Journal. 28: 254–258.
- ↑ F. Felderer, P. Fromherz, "Transistor needle chip for recording in brain tissue," Appl Phys A (2011) 104:1–6.
- ↑ Behrends, Jan C. & Fertig, Niels. "Patch-Clamp Analysis. Advanced Techniques" (PDF). nanion.de. Originaali (PDF) arhiivikoopia seisuga 27.01.2020. Vaadatud 27.01.2020.
{{netiviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ 15,0 15,1 Kandel, Eric R.; Schwartz, James Harris; Jessell, Thomas M., toim-d (2000). Principles of Neural Science (4th ed.). New York: McGraw-Hill. Lk 152–3. ISBN 978-0-8385-7701-1.
- ↑ Nobeli meditsiiniauhind 1991
- ↑ Duan X, Gao R, Xie P, Cohen-Karni T, Qing Q, Choe HS, Tian B, Jiang X, Lieber CM, "Intracellular recordings of action potentials by an extracellular nanoscale field-effect transistor," Nature Nanotechnology 2011
Viitamistõrge: <references>-siltide vahel olevat <ref>-silti nimega "HVUi3" ei kasutata eelnevas tekstis.
Viitamistõrge: <references>-siltide vahel olevat <ref>-silti nimega "mog0i" ei kasutata eelnevas tekstis.
Viitamistõrge: <references>-siltide vahel olevat <ref>-silti nimega "8LyaT" ei kasutata eelnevas tekstis.
Viitamistõrge: <references>-siltide vahel olevat <ref>-silti nimega "lmlVN" ei kasutata eelnevas tekstis.
Viitamistõrge: <references>-siltide vahel olevat <ref>-silti nimega "ZhGSj" ei kasutata eelnevas tekstis.
Viitamistõrge: <references>-siltide vahel olevat <ref>-silti nimega "2XcaB" ei kasutata eelnevas tekstis.
<references>-siltide vahel olevat <ref>-silti nimega "iRDzD" ei kasutata eelnevas tekstis.

