Molekuli polaarsus
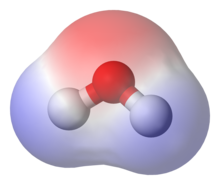
Aine molekulis aatomitevahelised keemilised sidemed moodustuvad ühiste elektronpaaride kaudu. Molekuli polaarsus tähendab elektrontiheduse (elektrilist laengute) nihkumist molekulis tulenevalt elektronide (elektronpilvede) nihutatud paiknemisest.
Elektronide ebaühtlane paiknemine aatomitevahelisel keemilisel sidemel viib positiivse ja negatiivse elektrilise laengu nihkumisele. Naaberaatomitel tekivad erimärgilised osalaengud, mida tähistatakse δ+ (delta pluss) ja δ- (delta miinus). Esineda võivad mittepolaarsed (näiteks H2), polaarsed (näiteks Hδ+Clδ-) või ioonilised sidemed (näiteks Na+Cl-). Polaarsel molekulil on elektriline dipoolmoment. Polaarsetel molekulidel esineb vastastikune toime dipool-dipool interaktsioonide ja vesiniksidemete kaudu.
Elektronide ebaühtlast paiknemist kahe aatomi vahel põhjustab aatomite erinev võime tõmmata elektrone oma poole (s.t. aatomite elektronegatiivsuste erinevus) ja molekuli struktuuri asümmeetria.
Vesi (H2O) kui polaarne ühend lahustab kergesti paljusid teisi polaarseid ja ioonilisi ühendeid, kuid halvasti mittepolaarseid ühendeid, nagu õlid ja rasvad. Suurtel molekulidel, mille ühes otsas on polaarsed rühmad ja teises mittepolaarsed, evivad pindaktiivsete ühendite omadusi.
Molekuli struktuur ja polaarsus[muuda | muuda lähteteksti]
Alljärgnev tabel lubab ennustada molekuli polaarsust tulenevalt tema struktuurist.
| Valem | Kirjeldus | Näide | |
| Polaarne | AB | Lineaarsed molekulid | CO |
|---|---|---|---|
| HAx | Molekulid ühe H aatomiga | HF | |
| AxOH | Otsmine OH-rühm molekulis | C2H5OH | |
| OxAy | Otsmine O-aatom molekulis | H2O | |
| NxAy | Otsmine N-aatom molekulis | NH3 | |
| Mittepolaarne | A2 | Mingi elemendi kaheaatomiline molekul | O2 |
| CxAy | Enamus süsinikühendeid | CO2 |
Molekuli polaarsus on seotud ühe või mitme polaarse kovalentse sidemega. Molekuli polaarsust mõjutavad struktuurifaktorid:
- aatomite elektronegatiivsused – mida suurem on elektronegatiivsuste erinevus, seda polaarsem on aatomitevaheline side; piirjuhud on mittepolaarne ja iooniline side
- aatomi polariseeruvus – väikeste aatomitega võrreldes polariseeruvad suured aatomid (näiteks jood) kergemini, s.t. rohkem kui tuleneb elektronegatiivsuste erinevusest
- molekuli suurus – mingi polaarse sideme mõju molekuli polaarsusele väheneb molekuli suuruse kasvades; näiteks etanool on vees lahustuv, kuid geraniool on õli
- molekuli sümmeetria – vastassuundades asuvate sidemete polaarsused võivad molekulis üksteist kompenseerida; näiteks boortrifluoriid (BF3) molekul on mittepolaarne, sest kolm sümmeetriliselt asetsevat polaarset B–F sidet kompenseerivad üksteist.
