Süsinik
See artikkel vajab toimetamist. (Juuli 2009) |
| 6 |
4 2 |
| C 12,01115 |
|
| Süsinik |

Süsinik (keemiline tähis C, ladina Carbonium) on mittemetalliline keemiline element järjenumbriga 6. Ta asub perioodilisustabeli IV A rühmas.
Tema valentskihis on 4 elektroni ja tema elektronkate on kirjeldatav valemiga 1s2 2s2 2p2. Süsinikul on seega kalduvus moodustada 4 sidet või vastaval arvul mitmekordseid sidemeid. Et süsinik moodustab palju vähepolaarseid kovalentseid sidemeid, on oksüdatsiooniastme määramine sageli raske.
Süsinikul on mitmeid allotroopseid vorme. Tavatingimustes on neist tuntuimad grafiit, tahm ja teemant. Kunstlikult saadud vormideks on grafeen, süsiniknanotorud, karbüünid, klaasjas süsinik ja fullereenid.
Süsiniku stabiilseim oksiid on süsihappegaas (CO2). Oluline on ka süsinikoksiid (CO).
Süsinik on oluline element orgaanilistes ühendites ja kesksel kohal orgaanilises keemias. Seetõttu nimetatakse seda keemiavaldkonda sageli ka süsinikukeemiaks.
Maa biosfääri seisukohast on äärmiselt oluline süsinikuringe, mis kujutab endast süsiniku liikumist ökosüsteemis erinevate ökosüsteemi komponentide vahel.
Süsinikuühendid[muuda | muuda lähteteksti]
Allotroobid[muuda | muuda lähteteksti]

Teemant[muuda | muuda lähteteksti]
Süsiniku allotroop teemant on tuntud kui kõige kõvem looduslik materjal. Heade mehaaniliste omaduste tõttu kasutatakse teda palju tööstuses. Põhjus, miks teemant nii kõva on, seisneb tema võrestruktuuris. Vastavalt valentssidemete teooriale toimub teemandis 2s- ja 2p-orbitaalide segunemine (hübridisatsioon), mille tulemusena moodustavad üks s- ja kolm p-orbitaali neli ekvivalentset sp3-hübriidset orbitaali, mis osutavad tetraeedri eri nurkadesse. Need tetraeedri nurgad on ühtlasi kuubi vastavad nurgad. Nii tekkinud kolmedimensionaalne võre on väga jäik. Sideme pikkus teemandi sp3-orbitaalidega süsinike vahel on 1,56 Å [1].
Grafiit[muuda | muuda lähteteksti]
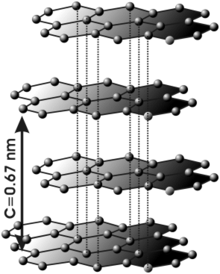
Grafiidis on sp2-hübriidsed orbitaalid, mis moodustavad σ-sidemeid. Sellega on iga aatom võrdselt seotud kolme teise süsinikuga. Nende sidemete vahel on xy-tasandil ±120° nurk ja z-telje sihis eksisteerib nõrk π-side. C-C sp2-orbitaali sideme pikkus on 1,42 Å. Kuusnurkne sp2-orbitaalidest sidemete struktuur moodustab tüüpilise grafiidi võre. Pz-orbitaal moodustab nõrga van der Waalsi sideme. Kaugus süsiniku kihtide vahel grafiidis on keskmiselt 3,35 Å. Pz-orbitaali elektronid liiguvad vabalt elektronpilves ja ei kuulu ühelegi kindlale aatomile (nad on delokaliseeritud). Selle tõttu juhib grafiit elektrit. Teemant seevastu käitub isolaatorina, sest kõik valentselektronid on lokaliseeritud sp3-orbitaalis. Grafiiti kasutatakse elektroodides, adsorbendina, pliiatsisüdamikes jne.[1]
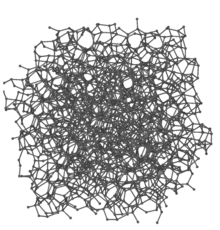
Amorfne süsinik[muuda | muuda lähteteksti]
Amorfne süsinik on süsiniku allotroop, millel puudub kaugeleulatuv korrapärane kristalne struktuur. Lokaalne korrapära võib eksisteerida, kuid selles esineb kõrvalekaldeid aatomitevahelistes kaugustes ja/või sidemete nurkades (võrreldes grafiidi või teemandi võrega)[2]. Amorfset süsinikku saadakse peamiselt kolmel viisil: keemilisel aurustus-sadestus meetodil (CVD), orgaaniliste ühendite lagundamisel, erinevate karbiidide selektiivsel söövitamisel. Amorfse süsinikuna tuntakse tahma, koksi ja puusütt[3].
Amorfset süsinikku saab kasutada elektrilise kaksikkihi kondensaatorites, vesiniku salvestamiseks, metaani salvestamiseks, liitiumioon patareides, süsinik-plaatina katalüsaatori kandjana.
Grafeen[muuda | muuda lähteteksti]

Süsiniku aatomite monokihiti, mis on sp2-sidemetega tihedalt kokku pakitud kahedimensionaalsesse kärgvõresse, nimetatakse grafeeniks. See on fundamentaalseks ehituskiviks kõigile teistele grafiidsetele materjalidele (0D fullereenidele, 1D nanotorudele, 3D grafiidile). Teoreetiliselt on grafeeni uuritud juba 60 aastat, kuid teda peeti pigem "akadeemiliseks" materjaliks, mille eksisteerimisse kahedimensionaalsena looduses termodünaamilise ebastabiilsuse tõttu ei usutud. Seda seni, kuni praeguseks juba Nobeli füüsikaauhinna laureaadid Andre Geim ja Konstantin Novosjolov selle vaid ühe aatomi paksuse materjali ootamatult avastasid. Hilisemad eksperimendid on kinnitanud ka relativistliku kondensmaterjaliga seotud teooriat, et selles on laengukandjateks massitud Diraci fermionid[4].
Fullereenid[muuda | muuda lähteteksti]

Fullereenid on ainult süsinikust koosnevad individuaalsed mitmetahulised molekulid. Kinniste keradena eristuvad nad teistest süsiniku allotroopidest, sest neid ei saa vaadelda lõputute süsteemidena nagu teemanti, grafiiti või grafeeni. C60 struktuur (ikosaeedriline rotatsiooni- ja peegelsümmeetriaga) sisaldab kahte eri tüüpi C-C sidemeid: lühemaid sidemeid (kaksiksidemed), mis on kuusnurga ühisteks servadeks (6-6 sidemed) ja pikemaid sidemed (üksiksidemed), mis tekivad kuusnurkade ja viisnurkade segunemisel (6-5 sidemed). C60 ja C70 fullereenides on enamus sidemetest 6-6 sidemed [5]. Fullereeni molekul on suurusjärgus 0,5 nm (C36) kuni 1,2 nm (C176) [6].
Süsiniku ühendid[muuda | muuda lähteteksti]
Orgaanilised ühendid[muuda | muuda lähteteksti]
 Pikemalt artiklis Orgaanilised ühendid
Pikemalt artiklis Orgaanilised ühendid
Valdav osa süsinikku sisaldavad ained, välja arvatud süsinik lihtainena ja mõned süsinikuühendid, mida arvatakse anorgaaniliste ainete hulka, on tuntud kui orgaanilised ühendid. Nende ühendite tohutut mitmekesisust (süsiniku ühendid moodustavad umbes 95% kõikidest tuntud keemilistest ühenditest) põhjustab süsiniku võime moodustada neli keemilist sidet. Täpsemalt, süsinik on ainulaadne keemiline element, sest tema aatomil on ergastatud valentsolekus väliskihis neli elektronorbitaali, milles on neli paardumata elektroni. Kõik see asetab süsiniku kesksele kohale orgaanilises keemias, biokeemias, kogu eluslooduses üldse.
Mitteorgaanilised ühendid[muuda | muuda lähteteksti]
Mitteorgaaniliste süsinikuühendite alla loetakse valdavalt süsiniku oksiidid (millest tuntuimad on CO ja CO2), sulfiidid (nagu CS2, OCS ja CS) ning lämmastikuühendid (nt (CN)2, HCN jt). Lisaks võib süsinik moodustada ühendeid mitmete metallidega.
Karbiidid on süsiniku ühendid metallide ja mõnede mittemetallidega, mille elektronegatiivsus on väiksem kui süsinikul. Karbiide kasutatakse põhilistes tööstuslikes rakendustes, kuna nad on kulumiskindlad, kuumuskindlad (kõrge sulamistemperatuuriga) ja kõrgetel temperatuuridel keemiliselt stabiilsed. Näidetena võib välja tuua soolataolise kaltsiumkarbiidi (CaC2), kovalentse ränikarbiidi (SiC), metallilise volframkarbiidi (WC), mida tihti kutsutakse tööstuses lihtsalt karbiidiks, ja siirdemetallilise tsementiidi (Fe3C).[7]
Eraldiseisvaks ainegrupiks on ka karboraanid. Samuti tuntakse süsiniku halogeniide, mis on süsiniku ühendid halogeenidega (nt CCl4).
Isotoobid[muuda | muuda lähteteksti]
Süsinikul on kaks stabiilset isotoopi massiarvudega 12 ja 13. Seejuures moodustab süsinik-12 98,9% Maal leiduvast süsinikust ja süsinik-13 vaid 1,1%.
Süsinik-12 võeti 1961. aastal aluseks aatommassiühiku väärtuse määramisel.[8]
Looduses leidub ka radioaktiivset isotoopi süsinik-14, mille massiarv on 14 ja poolestusaeg 5700 aastat. Süsinik-14 tekib kosmilise kiirguse toimel õhulämmastikust. Seda kasutatakse radiosüsinikumeetodil bioloogilist päritolu esemete vanuse määramiseks.
Süsinikuringe[muuda | muuda lähteteksti]

 Pikemalt artiklis Süsinikuringe
Pikemalt artiklis Süsinikuringe
Süsiniku liikumist ökosüsteemis erinevate ökosüsteemi komponentide vahel nimetatakse süsinikuringeks.
Tähtsaimad süsinikuringe protsessid on fotosüntees (mil anorgaaniline süsinik saab orgaaniliste ühendite koostisosaks) ja hingamine (mil orgaaniline süsinik vabaneb õhku või vette süsihappegaasina). Tasakaalus ökosüsteemis on kogufotosüntees võrdne koguhingamisega. Avatud ehk mittetasakaaluline süsinikringe toimub, kui süsinikku lisandub aineringesse ringevälistest allikatest (näiteks fossiilkütuste põletamisel), või kui süsinikühendeid väljub aineringest organismidele kättesaamatus vormis (nt orgaaniliste setete või turba moodustumisel).
Aktiivses ringluses oleva süsiniku hulga suurenemine põhjustab kasvuhooneefekti kasvu ja seeläbi globaalset soojenemist.
Vaata ka[muuda | muuda lähteteksti]
Viited[muuda | muuda lähteteksti]
- ↑ 1,0 1,1 M. Terrones, "Science and technology of the twenty-first century: synthesis, properties, and applications of carbon nanotubes," Annu. Rev. Mater. Res. 33, 419–501 (2003).
- ↑ A. D. McNaught, A. Wilkinson, "Amorphous carbon," kogumikus IUPAC Compendium of Chemical Terminology, (Royal Society of Chemistry, Cambridge, UK, 1997), lk 477.
- ↑ "Carbon (C)," kogumikust Encyclopædia Britannica (2011), http://www.britannica.com/EBchecked/topic/94732/carbon.
- ↑ A. K. Geim, K. S. Novoselov, "The rise of graphene," Nat. Mater. 6, 183–191 (2007).
- ↑ N. F. Goldshleger, "Fullerenes and fullerene-based materials in catalysis," Chem. Phys. 9:3, 255–280 (2001).
- ↑ A. Goel et al., "Size analysis of single fullerene molecules by electron microscopy," Carbon 42, 1907–1915 (2004).
- ↑ Greenwood,N.N.; Earnshaw,A. (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 318–22
- ↑ Carbon The Encyclopedia of Earth
Välislingid[muuda | muuda lähteteksti]
| Vikisõnastiku artikkel: süsinik |
| Pildid, videod ja helifailid Commonsis: Kategooria:Süsinik |
- Süsinik Materjalimaailm

