Aromaatsus
See artikkel ootab keeletoimetamist. (Märts 2024) |
Aromaatsuseks nimetatakse orgaanilises keemias konjugeeritud tsüklis olevate küllastumata sidemete, vabade elektronpaaride või tühjade orbitaalide tugevamat stabiliseerumist, kui seda konjugatsioon üksi võimaldaks. Keemiline aromaatsus ei tähenda ainete lõhna. Mõiste võttis kasutusele August Wilhelm Hoffmann 1855. aastal.[1]
Aromaatsust saab kirjelda tsüklilise delokalisatsooni ja resonantsiga, sest elektronid liiguvad tsüklis olevate aatomite vahel vabalt ning aatomite vahel varieeruvad üksik- ja kaksiksidemed.[2][3][4] Neid sidemeid võib võtta kui üksik- ja kaksiksideme hübriide, sest kõik sidemed tsüklis on teistega identsed. Aromaatsete tsüklite mudelit arendas benseeni põhjal Kekulé. Benseeni mudel koosneb kahest resonantsvormist, need annavad kokku 1,5 sidet aatomi kohta. Benseen on stabiilsem molekul kui laengu delokalisatsioon üksi võimaldaks.
Teooria[muuda | muuda lähteteksti]

Resonantsdiagrammidel näitab topeltnool, et kaks eraldi struktuuri ei ole omaette ühendid, vaid hüpoteetilised võimalused. Kumbki ei kirjelda tegelikku ühendit, paremini kujutab struktuuri kahe resonantsvormi hübriid. C=C side on lühem kui C-C side, kuid benseen on võrdsete külgedega kuusnurk, seega on sidemed molekulis võrdse pikkusega. Benseenis olevate sidemete pikkus on üksik- ja kaksiksideme keskmine.
Parem kirjeldus oleks ringikujuline π-side (pii-side), milles elektrontihedus on jagunenud võrdselt π-sidemetega tsükli üla- ja alaosas.
Üksiksidemed moodustatakse elektronidega, mis jäävad aatomite vahele, neid nimetatakse σ-sidemeteks. Kaksikside koosneb σ- ja π-sidemest. π-side tekib p-orbitaalide kattumisest tsükli üla- ja alaosas.
π-orbitaalid saavad üksteist vastastikku mõjutada ja delokaliseeruda, sest nad asuvad aatomite tasapinnast väljas. See võimaldab tsüklis olevatel süsinikuaatomitel elektrone jagada. Vaatamata sellele, et elektrone ei ole piisavalt, et moodustada kõigi C-aatomite vahel kaksiksidemeid, tugevdavad üksiksidemetest ülejäänud elektronid tsüklit võrdselt. Saadud molekulaarorbitaalil on π-sümmeetria.

Cooper, Geratt ja Raimondi vaidlustasid delokaliseeritud benseeni ja teiste aromaatsete ühendite kirjelduse oma artiklis[5], mis avaldati aastal 1986 ajakirjas Nature. Artiklis väidetakse, et benseeni molekuli elektronid on lokaliseeritud ja aromaatsed omadused tulenevad pigem spinnsidestusest kui elektronide delokalisatsioonist. Seda arvamust pooldas Nature'i järgmise aasta väljaanne [6][7][8] , kuid üldises keemikute kogukonnas pole see poolehoidu leidnud.
Ajalugu[muuda | muuda lähteteksti]
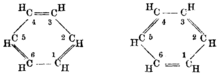
"Aromaatsuse" kui keemilise mõiste võttis teadaolevalt esimesena kasutusele August Wilhelm Hoffmann aastal 1855. Oma artiklis rakendas ta terminit ühenditele, mis sisaldasid fenüül radikaali.[1] Kui see on tõesti esimene termini kasutuselevõtt, siis on huvitav, miks Hoffmann kasutas omadussõna, millel on seos haistmisega, sellise ühendite rühma kohta, millest ainult mõnel on tuntav lõhn. Näiteks ühed lõhnavamad orgaanilised ained – terpeenid ei ole aromaatsed keemilises tähenduses, kuid terpeenid ja bensoeühendid on keemiliselt sarnased – neil on küllastamata sidemed, mis puuduvad alifaatsetel ühenditel. Hoffmann ei pruukinud teha vahet küllastamata sidemetel ja delokaliseerunud sidemetel. Tsükloheksatrieeni struktuuri pakkus esimesena välja August Kekulé aastal 1865. Järgmiste aastakümnete jooksul võttis enamik keemikuid selle heakskiiduga omaks, sest see seletas paljusid teadaolevaid aromaatse keemia isomeere. Kuid mõistmatuks jäi, miks see äärmiselt küllastumata molekul, on passiivne liitumisreaktsioonidele.
Elektroni avastaja J. J. Thomson asetas aastatel 1897–1906 kolm ekvivalentset elektroni igale sidemele benseenis.
Benseeni erakordse stabiilsuse seletus omistatakse üldiselt Sir Robert Robinsonile, kes nähtavasti võttis esimesena kasutusele aastal 1925 termini "aromaatne sekstett" – 6-elektroniline rühm, mis avaldab vastupanu välismõjudele.[10]
Idee on tegelikult varasem, seda käsitles Ernest Crocker oma 1922. aastal ilmunud artiklis[11] ja ka Henry Edward Armstrong 1890. aastal avaldatud artiklis "The structure of cycloid hydrocarbon"[12]. Oma artiklis kirjeldab Armstrong vähemalt 4 modernset mõistet. 1. tema niinimetatud "külgetõmbavust", tuntakse tänapäeval elektronina, mis avastati 7 aastat hiljem. 2. kirjeldab ta elektrofiilset aromaatset asendusreakstiooni, mis toimub läbi 3. Whelandi vaheoleku, mille tulemuseks 4. tsükli konjugatsioon lõhutakse. Arvatakse, et ta aimas ka lainemehaanika olemust, sest ta tõdes, et tema "külgetõmbavustel" on suund, ning ei ole lihtsalt punktosakesed ja need omavad kollektiivset jaotust, mida saab muuta, tuues benseeni molekuli lähedale teisi molekule – keha elektrontihedus muutub, kui see viia teise keha lähedusse.
Aromaatsuse kvantmehaanilise olemuse modelleeris esimesena Hückel aastal 1931. Tema oli esimene, kes eraldas sidemes olevad elektronid sigma ja pii elektronideks.
Aromaatsed ühendid[muuda | muuda lähteteksti]
Lihtsaim aromaatne ühend on benseen, mille tsükkel on heksagonaalne ja planaarne. Benseeni molekulis seovad 18 valentselektroni kuut süsinikuaatomit, kusjuures kõik sidemed on identsed – kõik 18 elektroni on "laiali määritud" üle kogu tsükli.
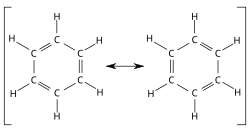
π-elektronide delokalisatsiooni benseeni molekulis kujutavad kolm alternatiivset struktuurivalemit:
|

|
|
Keemilistes struktuurides kirjutatakse tihti vaheldumisi üksik- ja kaksiksidemed, kuigi kõik sidemed on ekvivalentsed 1,5-sidemed. Seega pole õige väita, et aromaatsetes ühendites on üksik- ja kaksiksidemed vaheldumisi, vaid tegu on aromaatsete konjugeeritud sidemetega. Sarnane elektronide delokalisatsioon esineb ka sellistes polütsüklilistes aromaatsetes süsteemides nagu naftaleen, antratseen, bifenüül, asuleen jt.
Üldisema definitsiooni kohaselt esineb aromaatsetes ühendites π-orbitaalide kattumine üle kogu ringstruktuuri (tsükli). Juhule 18 valentselektroni tsüklis, nii nagu benseeni molekulis, vastab kolm aromaatset süsteemi: benseen, tsükloheptatrienüülkatioon (tropüüliumioon) ja tsüklopentadienüülanioon:
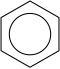
|

|

|
Laiemas mõttes kuuluvad aromaatsete ühendite klassi ka mittebensoidsed ühendid nagu püridiin, furaan, tiofeen, pürrool jt, mis sisaldavad heteroaromaatseid tsükleid. Kõigis nendes ühendites avaldab tsüklisisene konjugatsioon tugevat stabiliseerivat toimet.
Aromaatsetele ühenditele iseloomulik suletud konjugatsiooniahel saab moodustuda, kui:
- molekul on tsükliline;
- iga tsükli aatom omab p-orbitaali, mis kattub p-orbitaalidega mõlemale poolele;
- molekul on planaarne;
- π-orbitaalsüsteem sisaldab 4n + 2 elektroni (n = 0,1,2,3...).
Aromaatse tsükli stabiilsusest tulenevalt ei astu need ühendid liitumisreaktsioonidesse nii nagu teised küllastumata ühendid, kuid tsükli vesinikuaatomid on asendatavad teiste aatomite või rühmadega.
Näiteid[muuda | muuda lähteteksti]
Polütsüklilised aromaatsed süsivesinikud, heterotsüklilised aromaatsed ühendid ja asendusrühmi sisaldavad aromaatsed ühendid:
-
Aspiriin ehk atsetüülsalitsüülhape
Aromaatsete ühendite (areenide) omadused[muuda | muuda lähteteksti]
Aromaatne molekul koosneb kovalentselt seotud aatomitest, millel on kindlad omadused:
- delokaliseeritud pii-süsteem – kõige sagedamini vahelduvad üksik- ja kaksiksidemed;
- planaarne struktuur – kõik delokalisatsioonis osalevad aatomid on samal tasandil;
- panustavad aatomid on organiseerunud ühte või mitmesse tsüklisse;
- π-orbitaalsüsteem sisaldab 4n + 2 elektroni (n = 0,1,2,3...). Seda tuntakse Hückeli reeglina.
Benseen on aromaatne, sest omab 6 elektroni kolmest kaksiksidemest, kuid näiteks tsüklobutadieen ei ole, sest omab 4 π elektroni, samas tsüklobutadieeni (2-) anioon on aromaatne, sest süsteemi on lisandunud 2 elektroni, kokku 6. Aatom aromaatses süsteemis võib omistada elektrone väljastpool süsteemi ja seega ignoreerida 4n + 2 reeglit. Furaanis on hapnikuaatom sp2 hübridiseerunud. Üks vaba elektronpaar asetseb π süsteemis ja teine asub väljaspool tsüklit analoogselt C-H sidemete asukohale. Furaanis on 6 π-elektroni, seega on see aromaatne.
Aromaatsetele ühenditele on iseloomulik suurem keemiline stabiilsus võrreldes sarnaste mittearomaatsete molekulidega. Molekul, millel on võimalik olla aromaatne, kaldub muutma oma elektron- või konformatsioonilist struktuuri, et saavutada elektronide delokalisatsioon. Lisandunud stabiilsus muudab molekuli keemilisi omadusi. Aromaatsed ühendid võtavad osa elektrofiilsest aromaatsest asendusreaktsioonist, nukleofiilsest aromaatsest asendusreaktsioonist, kuid mitte elektrofiilsest liitumisreaktsioonist, mis on iseloomulik C=C sidemetele.
Välise magnetvälja rakendamisel hakkavad aromaatse süsteemi elektronid mööda tsüklit liikuma – tekib ringvool, mille tekitatud magnetväli on vastupidine välisele magnetväljale.[13] Tsükliga samal tasapinnal olevate prootonite TMR signaal nihkub tunduvalt rohkem allavälja, võrreldes mittearomaatsete sp2-süsinikega. Prootoni signaal, mis asub tsükli telje lähedal nihkub ülesvälja. See on oluline moodus molekuli aromaatsuse avastamiseks TMR-i spektris.
Planaarsed monotsüklid, mis sisaldavad 4n π elektroni nimetatakse antiaromaatseteks ja on üldjuhul destabiliseeritud. Molekulid, mis on võimelised olema antiaromaatsed väldivad seda muutes oma elektron või konformatsioonilist struktuuri. Näiteks tsüklooktatrieen deformeerib enda planaarse struktuuri, murdes sellega π-orbitaalide kattuvuse. Asümmeetriline konfiguratsioon kaalub üles antiaromaatse destabilisatsiooni, mis kaasneks sümmeetrilise struktuuriga.
Aromaatsete ühendite tähtsus[muuda | muuda lähteteksti]
Aromaatsed ühendid omavad võtmerolli kõikide elusolendite biokeemias. Histidiin, fenüülalaniin, trüptofaan ja türosiin on olulised ehituskivid proteiinides. Kõik viis nukleotiidi – adeniin, tümiin, tsütosiin, guaniin ja uratsiil – on aromaatsed puriinid või pürimidiinid. Molekul Heem sisaldab aromaatset süsteemi 22 π-elektroniga, klorofüll omab sarnast aromaatset süsteemi.
Aromaatsed ühendid on tähtsad tööstusele. Benseen, tolueen, ortoksüleen ja paraksüleen on majanduslikult tähtsad kemikaalid. Ligikaudu 35 miljonit tonni toodetakse üle maailma aastas. Neid toodetakse naftast rafineerimisel või destilleerimisel kivisöetõrvast ning kasutatakse paljude oluliste kemikaalide valmistamisel, näiteks stüreen, fenool, aniliin, polüestrid ja nailon.
Aromaatsete ühendite liigid[muuda | muuda lähteteksti]
Enamik aromaatseid ühendeid on süsiniku baasil, kuid need ei pea olema süsivesinikud.
Neutraalsed homotsüklid[muuda | muuda lähteteksti]
Benseen ja paljud teised täielikult konjugeeritud monotsüklid valemiga CnHn, kus n on paariarv, välja arvatud tsüklodekapenteen.
Heterotsüklid[muuda | muuda lähteteksti]
Heterotsüklites on üks või mitu C-aatomit asendatud mingi muu elemendi aatomiga. Asendus võib vähendada aromaatsust ja muuta tsükli reaktiivsemaks, näiteks furaan, kus on 1 hapnikuaatom asendanud süsiniku.
Polütsüklid[muuda | muuda lähteteksti]
Polütsüklilised aromaatsed süsivesinikud on molekulid, mis sisaldavad ühte või rohkemat aromaatset süsteemi, mis on seotud omavahel 2 külgneva süsinikuga. Näiteks naftaleen, antratseen ja fenantreen.
Funktsionaalrühmad[muuda | muuda lähteteksti]
Aromaatsed ühendid võivad sisaldada funktsionaalrühmi vesinike asemel. Tuntuimad näited oleksid lõhkeaine trinitrotolueen (TNT), atsetüülsalitsüülhape (aspiriin) ja atsetaminofeen (paratsetamool).
Ebatavalised aromaatsed ühendid[muuda | muuda lähteteksti]
Aromaatsus leidub ka ioonides, näiteks: tsüklopropeeni katioon (2e), tsüklopentadieeni anioon (6e) ja tsüklooktatetraeen dianioon (10e). Aromaatsed omadused võivad tekkida molekulis, kui lisada sobiv funktsionaalrühm, näiteks tsükloheptatrieen ei ole aromaatne, kuid 2,4,6 tsükloheptatrieen-1-oon on aromaatne.
Homoaromaatsus on aromaatsuse liik, kus konjugatsiooni on rikkunud üksik sp3 hübridiseerunud süsinikuaatom.
Aromaatsus anorgaanilistes ühendites[muuda | muuda lähteteksti]
Aromaatsus on omane ka ühenditele, mis ei ole orgaanilised. Selliste ühendite puhul on võimalik kaks tüüpi aromaatsust: planaarne aromaatsus, mille puhul ühendid peavad täitma samu aromaatsuse reegleid nagu orgaanilised ühendid, ning sfääriline aromaatsus, mille puhul aromaatsuse tingimused on teistsugused. Sfäärilise aromaatsuse tingimused on järgmised:
- molekul peab olema sfäärilise geomeetriaga.
- delokaliseeritud π-orbitaalsüsteemis peab olema 2(n+1)2 elektroni, mis on võrdne ka üksiku aatomi täidetud kihi elektroni arvuga (2, 8, 18, 32, 50, 72, ...).[14]
Süsinikuühendid[muuda | muuda lähteteksti]
Mitmed süsiniku allotroobid on aromaatsed, nagu näiteks grafiit, grafeen, süsiniknanotorud. Neid aineid võib põhimõtteliselt vaadelda ka lõpmata suurte polütsükliliste aromaatsete ühenditena.
Fullereenid on süsiniku allotroobid, mis võivad olla aromaatsed, kuid nende puhul on tegemist sfääriliste molekulidega ning seetõttu ka sfäärilise aromaatsusega. Tuntud fullereen C60 ei ole aromaatne, kuna temal on 60 π-elektroni, mis ei täida sfäärilise aromaatsuse reeglit. Tema kaaliumi sool K12C60 aga on aromaatne, sest anioonil C6012− on 72 π-elektroni.[14]
Orgaaniliste tsüklite anorgaanilised analoogid[muuda | muuda lähteteksti]
Mitmetele orgaanilistele aromaatsetele tsüklitele on sünteesitud vastavaid anorgaanilisi analooge, millest enamus on lämmastiku või boori ühendid. Näiteks on lämmastiku allotroobi pentasooli anioon N5− aromaatne, kuna ta sisaldab analoogselt vastavale süsiniku ühendile tsüklopentadieeni anioonile 6 π-elektroni. Borasiinn on benseeni analoog, kus süsiniku aatomid on asendatud vahelduvate lämmastiku ja boori aatomitega.
Boraanid[muuda | muuda lähteteksti]
Boraanid on boori ja vesiniku ühendid, mis on analoogsed süsivesinikele (alkaanidele), kuid erinevalt alkaanidest, boraanid kipuvad moodustama sfäärilise geomeetriaga molekule. Seetõttu boraanide sidemeid ja aromaatsust kirjeldab hästi sfäärilise aromaatsuse mõiste.[15]
Karboraanid on boraanid, kus vähemalt üks boori aatom on asendatud süsinikuga. Sellised ühendid on ülitugevad happed tugeva elektronide delokalisatsiooni tõttu vastavas konjugeeritud aluse anioonis. Karboraanhapped pakuvad huvi seetõttu, et nad on väga tugevad happed, kuid samal ajal erinevalt Lewis'i aluse+happe paaril põhinevatest superhapetest (nt HF/SF5) on nad mitteoksüdeerivad, mis annab neile huvitavaid omadusi ja teoreetilisi rakendusi.
Aromaatsed metallilised ühendid[muuda | muuda lähteteksti]
Aromaatsuse nähtus esineb ka mõningates metallide ühendites. Näiteks on planaarse aromaatsusega alumiiniumi anioon Al42− [16] ning sfäärilise aromaatsusega kulla klastrid Au32[17] ja Au50[18].
Vaata ka[muuda | muuda lähteteksti]
Viited[muuda | muuda lähteteksti]
- ↑ 1,0 1,1 August Wilhelm Hoffmann. "On Insolinic Acid" (inglise keeles).
{{netiviide}}: CS1 hooldus: tundmatu keel (link) - ↑ Paul von Ragué Schleyer. "Introduction: Aromaticity" (inglise keeles).
{{netiviide}}: CS1 hooldus: tundmatu keel (link) - ↑ Alexandru T. Balaban , Paul v. R. Schleyer , Henry S. Rzepa. "Begat the Six Aromatic Electrons" (inglise keeles).
{{netiviide}}: CS1 hooldus: mitu nime: autorite loend (link) CS1 hooldus: tundmatu keel (link) - ↑ Paul von Ragué Schleyer. "Introduction: Delocalization-Pi and Sigma" (inglise keeles).
{{netiviide}}: CS1 hooldus: tundmatu keel (link) - ↑ David L. Copper, Joseph Gerratt, Mario Raimondi. "The electronic structure of the benzene molecule" (inglise keeles).
{{netiviide}}: CS1 hooldus: mitu nime: autorite loend (link) CS1 hooldus: tundmatu keel (link) - ↑ Linus Pauling. "Electronic structure of the benzene molecule" (inglise keeles).
{{netiviide}}: CS1 hooldus: tundmatu keel (link) - ↑ Richard P. Messmer & Peter A. Schultz. "The electronic structure of the benzene molecule" (inglise keeles).
{{netiviide}}: CS1 hooldus: tundmatu keel (link) - ↑ Richard D. Harcourt. "The electronic structure of the benzene molecule" (inglise keeles).
{{netiviide}}: CS1 hooldus: tundmatu keel (link) - ↑ August Kekulé. "Ueber einige Condensationsproducte des Aldehyds" (saksa keeles).
{{netiviide}}: CS1 hooldus: tundmatu keel (link) - ↑ James Wilson Armit, Robert Robinson. "CCXI.—Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases" (inglise keeles).
{{netiviide}}: CS1 hooldus: tundmatu keel (link) - ↑ Ernest C. Crocker. "APPLICATION OF THE OCTET THEORY TO SINGLE-RING AROMATIC COMPOUNDS" (inglise keeles).
{{netiviide}}: CS1 hooldus: tundmatu keel (link) - ↑ Henry Edward Armstrong. "The structure of cycloid hydrocarbon" (inglise keeles).
{{netiviide}}: CS1 hooldus: tundmatu keel (link) - ↑ Gabriel Merino, Thomas Heine, Gotthard Seifert. "The Induced Magnetic Field in Cyclic Molecules" (inglise keeles).
{{netiviide}}: CS1 hooldus: mitu nime: autorite loend (link) CS1 hooldus: tundmatu keel (link) - ↑ 14,0 14,1 Andreas Hirsch; et al. "Spherical Aromaticity in Ih Symmetrical Fullerenes: The 2(N+1)2 Rule" (inglise keeles).
{{netiviide}}: et al.-i üleliigne kasutus kohas:|Autor=(juhend)CS1 hooldus: tundmatu keel (link) - ↑ Zhongfang Chen; et al. "Spherical Aromaticity: Recent Work on Fullerenes, Polyhedral Boranes, and Related Structures" (inglise keeles).
{{netiviide}}: et al.-i üleliigne kasutus kohas:|Autor=(juhend)CS1 hooldus: tundmatu keel (link) - ↑ Chang-Guo Zhan; et al. "Electron Affinities of Aln Clusters and Multiple-Fold Aromaticity of the Square Al42- Structure" (inglise keeles).
{{netiviide}}: et al.-i üleliigne kasutus kohas:|Autor=(juhend)CS1 hooldus: tundmatu keel (link) - ↑ Mikael P. Johansson; et al. "Au32: A 24-Carat Golden Fullerene" (inglise keeles).
{{netiviide}}: et al.-i üleliigne kasutus kohas:|Autor=(juhend)CS1 hooldus: tundmatu keel (link) - ↑ Jinlan Wang, Julius Jellinek. "Hollow Cages versus Space-Filling Structures for Medium-Sized Gold Clusters: The Spherical Aromaticity of the Au50 Cage" (inglise keeles).
{{netiviide}}: CS1 hooldus: tundmatu keel (link)











