Streptavidiin
Streptavidiin on 52,8 kDa suurune valk, mida toodab bakter Streptomyces avidinii. Streptavidiini homotetrameerid seonduvad väga tugevasti biotiiniga (tuntud ka kui B7-vitamiin). See on teadaolevalt üks tugevamaid looduses esinevaid mittekovalentseid seondumisi: selle dissotsiatsioonikonstant on Kd ≈10−14mol/L[1].
Streptavidiini-biotiini kompleks on väga vastupidav orgaanilistele solventidele, denatureerivatele ainetele (naatriumdodetsüülsulfaat, triitium), proteolüütilistele ensüümidele, äärmuslikele temperatuuridele ja pH-le. Seetõttu kasutatakse streptavidiini laialdaselt molekulaarbioloogias ja biotehnoloogias.
Struktuur[muuda | muuda lähteteksti]

Biotiiniga seostunud streptavidiini kristallstruktuuri kirjeldasid esimest korda 1989. aastal Wayne A. Hendrickson jt.[2] 159 aminohappejäägist koosneva täispikkuses valgu N- ja C-terminaalset otsa töödeldakse, et saada lühem "algeline" streptavidiin, mis tavaliselt koosneb 13–139 aminohappejäägist; N- ja C-terminaalse otsa eemaldamine on vajalik, tagamaks biotiini kõrge afiinsusega kinnitumist. Streptavidiini monomeeri sekundaarstruktuur koosneb kaheksast antiparalleelsest β-lehe struktuurist, mis voltuvad kokku antiparalleelseks beeta-silindri tertsiaarstruktuuriks. Beeta-silindri mõlemas otsas on biotiini seostumiskoht. Neli identset streptavidiini monomeeri liituvad, et moodustada streptavidiini tetrameerne kvaternaarstruktuur. Biotiini seostumiskohad iga β-silindri mõlemas otsas koosnevad silindri sisemusest tulnud jääkidest koos kõrvalolevast alaühikust pärineva muutumatuks jäänud Trp120-ga. Seeläbi aitab iga alaühik kõrvaloleval alaühikul paiknevat seostumiskohta tugevdada, seega võiks sellist tetrameeri käsitleda ka kui funktsionaalsetest dimeeridest koosnevat dimeeri.
Kõrge afiinsuse tagamaad[muuda | muuda lähteteksti]
Arvukad uurimise all olevad streptavidiini-biotiini kompleksi kristallstruktuurid annavad aimu märkimisväärselt suure afiinsuse päritolu kohta:
- Seostumiskoha tasku ja biotiini vahel esineb tugev struktuurne komplementaarsus.
- Seostumiskohas moodustub biotiiniga ulatuslik vesiniksidemete võrgustik. Seostumiskohas paiknevate jääkidega seob biotiini vahetult 8 vesiniksidet – nii-öelda esimene kiht vesiniksidemeid, milles osalevad järgnevad aminohappejäägid: Asn23, Tyr43, Ser27, Ser45, Asn49, Ser88, Thr90 ja Asp128. On ka teine kiht vesiniksidemeid, milles osalevad esimese kihi aminohappejääkidega omakorda interakteeruvad jäägid.
- Ainuüksi vesiniksidemed ei suudaks moodustada niivõrd suure afiinsusega sidet, nagu seda on streptavidiini-biotiini side, seega on tõenäoline, et suurt afiinsust põhjustavad lisaks teisedki mehhanismid:[3] biotiini seostumistasku on hüdrofoobne, biotiini molekuli hoiavad taskus kinni hüdrofoobsed interaktsioonid.
- Arvatakse ka, et mitmed van der Waalsi jõud biotiini ja seostumiskoha vahel suurendavad afiinsust. Eriti oluline on seejuures see, et taskut vooderdavad konserveerunud trüptofaani jäägid.
- Biotiini sidumisele aitab kaasa ka stabiliseeriva omadusega painduv aas, mis ühendab omavahel β-ahela keermeid 3 ja 4 (L3/4). See aas sulgub seostunud biotiini peal ning toimib kui "kaas", mis aitab kaasa biotiini erakordselt aeglasele dissotsiatsioonimäärale.
Suurem osa katsetest streptavidiini struktuuri muuta vähendab biotiini seostumise afiinsust, mida võib ka oodata niivõrd optimeeritud süsteemi puhul. Sellegipoolest on hiljuti suudetud tehislikult luua streptavidiini mutant traptavidiin, mille puhul leiti, et biotiini dissotsiatsioonikiirus vähenes kümme korda. Lisaks sellele on treptavidiinil suurem termiline ja mehaaniline stabiilsus.[4] Vähenenud dissotsiatsioonikiirusega kaasnes ka kahekordne assotsiatsioonikiiruse langus.
Rakendused biotehnoloogias[muuda | muuda lähteteksti]
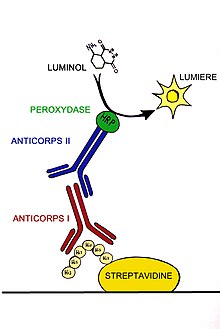
Kõige laiemalt kasutatakse streptavidiini puhastamisel või erinevate biomolekulide määramisel.
- Streptavidiini-biotiini tugevat sidet saab kasutada mitmesuguste biomolekulide üksteise või kandja külge kinnitamiseks. Streptavidiini-biotiini sidemete lõhkumiseks on vaja rakendada äärmuslikke tingimusi, mille tulemusena denatureerub tihti ka uuritav valk, mida puhastatakse. Siiski on teada, et lühiajaline inkubatsioon üle 70-kraadises vees lõhub pöörduvalt sidemed, seejuures denatureerimata streptavidiini – nii saab taaskasutada streptavidiini kandjat.[5]
- Üheks aplikatsiooniks on ka niinimetatud Strep-tagi meetod, mis on optimeeritud süsteem valkude puhastamiseks ja määramiseks.
- Streptavidiini kasutatakse laialdaselt Western blot'is ja immunoloogilises analüüsis konjugeerituna mõne markermolekuli (nt HRP) külge.
- Streptavidiini kasutatakse ka kiirelt arenevas nanobiotehnoloogia vallas: bioloogiliste molekulide, nagu valkude või lipiidide kasutamine nanoskaalas seadeldiste/struktuuride loomiseks. Selles kontekstis saab streptavidiini kasutada n-ö ehituskivina, et omavahel ühendada biotinüleeritud DNA molekulid, moodustades üheseinalise süsiniknanotoru kinnitused[6] või isegi kompleksse DNA polüeedri.[7]
- Veel leiab streptavidiin kasutust molekulaarjõu sondina aatomijõumikroskoobis.[8]
Suunatud immuunravi[muuda | muuda lähteteksti]
Suunatud immuunravis kasutatakse monoklonaalsele antikehale konjugeeritud streptavidiini, mis kinnitub vähiraku spetsiifilisele antigeenile. Kui streptavidiiniga seotud monoklonaalne antikeha on antigeeniga seostunud, siis süstitakse organismi radioaktiivse märgisega biotiin, mis seostub streptavidiiniga; sedaviisi õnnestub kiiritada ainult vähirakke. Raskusi tekitab biotiini seostumiskohtade küllastumine endogeense biotiiniga, mis takistab süstitud radioaktiivse märgisega biotiini seostumist. Peale selle on probleemiks veel ka suur radioaktiivse kiirituse oht neerudele, kuna streptavidiin adsorbeerub kergesti rakkudele. Seni ollakse seisukohal, et suur siduvus sarnaste rakutüüpide vahel, nagu näiteks aktiveeritud trombotsüüdid ja melanoomi rakud, on põhjustatud integriiniga seondumisest, mida vahendab streptavidiinis paiknev RYD järjestus. [9]
Monovalentse ja monomeerse streptavidiini võrdlus[muuda | muuda lähteteksti]
Streptavidiin on tetrameer, mille iga alaühik seob biotiini võrdse afiinsusega. Multivalentsus on mõne rakenduse puhul kasulik, näiteks olukord, kus "ahnuse" efekt parandab streptavidiiniga seotud molekulide võimet tuvastada spetsiifilisi T-rakke.[10] Teistel juhtudel, nagu streptavidiini kasutamisel kindlate valkude kujutamiseks rakkudel, võib multivalentsus häirida uuritava valgu funktsiooni. Monovalentne streptavidiin on tehniliselt töödeldud rekombinant tetrameersest streptavidiinist, kus ainult üks neljast seostumiskohast on funktsionaalne. Sellel ainukesel töötaval seostumiskohal on afiinsus väärtusega 10−14 mol/L ja ristsidumine ei ole võimalik.[11] Monovalentset streptavidiini levitab Oxfordi Ülikool. Monomeerne streptavidiin on rekombinantne vorm streptavidiinist, mille tetrameer on lõhutud monomeerideks ning mutatsioonide teel on võimendatud saadava isoleeritud alaühiku lahustuvust. Monomeerse streptavidiini variandid on afiinsusega biotiini suhtes 10−7 mol/L ja 10−8 mol/L ning seega ei ole need ideaalsed märgistamiseks, kuid see-eest on kasulikud valkude puhastamisel, kus on soovitud reaktsiooni pöörduvus.[12][13]
Võrdlus avidiiniga[muuda | muuda lähteteksti]

Streptavidiin ei ole ainuke valk, mis on võimeline siduma biotiini kõrge afiinsusega. Avidiin on teine kõige märkimisväärsem biotiini siduv valk. Algselt munavalgest eraldatud avidiinil on streptavidiiniga sarnane aminohappeline järjestus ainult 30% ulatuses, aga peaaegu identne sekundaar-, tertsiaar- ja kvaternaarstruktuur. Avidiinil on kõrgem afiinsus biotiiniga kui streptavidiinil (Kd ~10−15M), aga avidiin on glükosüleeritud, positiivselt laetud, omab pseudo-katalüütilist aktiivsust (on võimeline suurendama biotiini ja nitrofenüülgrupi vahelise estersideme leelishüdrolüüsi) ja agregeerub kergemini. Lisaks sellele on streptavidiin parem biotiini-konjugeeritud molekuli siduja; avidiinil on madalam seostumisafiinsus kui streptavidiinil, juhul kui biotiin on seotud teise molekuliga. Vaba biotiini korral on seostumisafiinsus suurem avidiinil. Streptavidiinil on kergelt happeline isoelektriline punkt (pI ~5), aga saadaval on ka streptavidiini rekombinantne vorm peaaegu neutraalse pI-väärtusega. Kuna streptavidiinil puudub igasugune sahhariidi modifikatsioon ja sel on praktiliselt neutraalne pI-väärtus, siis on streptavidiini eeliseks avidiiniga võrreldes madalam mittespetsiifiline seondumine. Deglükosüleeritud avidiin (neutravidiin) on suuruse, pI ja ebaspetsiifilise seondumise poolest lähedasem streptavidiinile.
Viited[muuda | muuda lähteteksti]
- ↑ Green, NM (1975). "Avidin". Advances in protein chemistry. 29: 85–133. PMID 237414.
- ↑ Hendrickson, W. A. (1989). "Crystal Structure of Core Streptavidin Determined from Multiwavelength Anomalous Diffraction of Synchrotron Radiation". Proceedings of the National Academy of Sciences. 86 (7): 2190–4. DOI:10.1073/pnas.86.7.2190. PMC 286877. PMID 2928324.
- ↑ Dechancie, Jason; Houk, K. N. (2007). "The Origins of Femtomolar Protein–Ligand Binding: Hydrogen Bond Cooperativity and Desolvation Energetics in the Biotin–(Strept)Avidin Binding Site". Journal of the American Chemical Society. 129 (17): 5419–29. DOI:10.1021/ja066950n. PMC 2527462. PMID 17417839.
- ↑ Chivers, Claire E; Crozat, Estelle; Chu, Calvin; Moy, Vincent T; Sherratt, David J; Howarth, Mark (2010). "A streptavidin variant with slower biotin dissociation and increased mechanostability". Nature Methods. 7 (5): 391–3. DOI:10.1038/nmeth.1450. PMC 2862113. PMID 20383133.
- ↑ Holmberg, Anders; Blomstergren, Anna; Nord, Olof; Lukacs, Morten; Lundeberg, Joakim; Uhlén, Mathias (2005). "The biotin-streptavidin interaction can be reversibly broken using water at elevated temperatures". Electrophoresis. 26 (3): 501–10. DOI:10.1002/elps.200410070. PMID 15690449.
- ↑ Osojic, GN; Hersam, MC (2012). "Biomolecule-Directed Assembly of Self-Supported, Nanoporous, Conductive, and Luminescent Single-Walled Carbon Nanotube Scaffolds". Small. 8 (12): 1840–5. DOI:10.1002/smll.201102536. PMID 22461319.
- ↑ Zhang, C; Tian, C; Guo, F; Liu, Z; Jiang, W; Mao, C (2012). "DNA-Directed Three-Dimensional Protein Organisation". Angew Chem Int Ed Engl. 15 (14): 3382–3385. DOI:10.1002/anie.201108710. PMID 22374892.
- ↑ Kim, M; Wang, CC; Benedetti, F; Marszalek, PE (2012). "A Nanoscale Force Probe for Gauging Intermolecular Interactions". Angew Chem Int Ed. 51 (8): 1903–1906. DOI:10.1002/anie.201107210. PMID 22253141.
- ↑ Alon, R; Bayer, EA; Wilchek, M (1992). "Cell-adhesive properties of streptavidin are mediated by the exposure of an RGD-like RYD site". European Journal of Cell Biology. 58 (2): 271–9. PMID 1425765.
- ↑ Xu, X; Screaton, GR (2002). "MHC/peptide tetramer-based studies of T cell function". Journal of Immunological Methods. 268 (1): 21–8. DOI:10.1016/S0022-1759(02)00196-5. PMID 12213339.
- ↑ Howarth, Mark; Chinnapen, Daniel J-F; Gerrow, Kimberly; Dorrestein, Pieter C; Grandy, Melanie R; Kelleher, Neil L; El-Husseini, Alaa; Ting, Alice Y (2006). "A monovalent streptavidin with a single femtomolar biotin binding site". Nature Methods. 3 (4): 267–73. DOI:10.1038/nmeth861. PMC 2576293. PMID 16554831.
- ↑ Wu, S.-C.; Wong, SL (2005). "Engineering Soluble Monomeric Streptavidin with Reversible Biotin Binding Capability". Journal of Biological Chemistry. 280 (24): 23225–31. DOI:10.1074/jbc.M501733200. PMID 15840576.
- ↑ Lim, K (2011). "Engineered streptavidin monomer and dimer with improved stability and function". Biochemistry. 50 (40): 8682–91. DOI:10.1021/bi2010366. PMID 21892837.
Kirjandus[muuda | muuda lähteteksti]
- Hutchens, T. W.; Porath, J. O. (1987). "Protein recognition of immobilized ligands: promotion of selective adsorption". Clinical Chemistry. 33 (9): 1502–8. PMID 3621554.
- Chodosh, Lewis A.; Buratowski, Stephen (2001). "Purification of DNA-Binding Proteins Using Biotin/Streptavidin Affinity Systems". Current Protocols in Protein Science. 9.7.1–9.7.13. DOI:10.1002/0471140864.ps0907s12. ISBN 978-0-471-14086-3.
{{cite book}}: eiran tundmatut parameetrit|nopp=, kasuta parameetrit (|no-pp=) (juhend) - Zimmermann, Ralf M.; Cox, Edward C. (1994). "DNA stretching on functionalized gold surfaces". Nucleic Acids Research. 22 (3): 492–7. DOI:10.1093/nar/22.3.492. PMC 523609. PMID 8127690.
Välislingid[muuda | muuda lähteteksti]
- Department of Biochemistry, University of Oxford
- Swiss-Prot entry for Streptavidin precursor from Streptomyces avidinii
- Egg-stremely useful interaction QUite Interesting PDB Structure article at PDBe
Groups investigating and developing streptavidin or avidin-family proteins (Alphabetical order)
