Sindbisi viirus: erinevus redaktsioonide vahel
P Whisfel teisaldas lehekülje Sindbis viirus pealkirja Sindbisi viirus alla: tegemist on kohanimega, peaks olema omastav kääne |
keeletoimetus |
||
| 1. rida: | 1. rida: | ||
| ⚫ | |||
{{keeletoimeta}} |
|||
| ⚫ | '''Sindbisi viirus''' kuulub ''[[Togaviridae]]'' sugukonda [[alfaviirus]]te perekonda.<ref name="viralzone" /> Alfaviirused on geograafiliselt väga laialt levinud. Neid on leitud kõikidelt kontinentidelt.<ref name="strauss" /> Tegemist on [[Sääselised|sääskede]] kaudu leviva viirusega, mis põhjustab [[Lööve|löövet]] ja [[artriit]]i. Sindbisi viirus tuvastati ja isoleeriti esimesena sääskedelt [[Niilus]]e jõe deltast [[Egiptus]]es 1952. aastal. Infektsioone on tuvastatud [[Põhja-Euroopa|Põhja-Euroopas]], [[Lõuna-Aafrika|Lõuna-Aafrikas]], [[Austraalia|Austraalias]], [[Hiina|Hiinas]] ja [[Soome|Soomes]].<ref name="zgGuO" /> |
||
| ⚫ | |||
| ⚫ | ''' |
||
==Struktuur== |
==Struktuur== |
||
Sindbisi viiruse [[Virion|virioni]] ehitus on lihtne. Struktuursed teadmised viirusest põhinevad [[Elektronmikroskoop|krüoelektronmikroskoopial]] ja [[XRD|röntgenkristallograafilistel]] analüüsidel.<ref name="zhang" /> [[Virion]] koosneb ikosaeedrilisest [[nukleokapsiid]]ist, mida ümbritseb [[Lipiidid|lipiidne]] ümbris. Ümbris koosneb kahest viiruslikust [[Glükoproteiinid|glükoproteiinist]], E1st ja E2st. E2 vastutab peamiselt viirusinfektsiooni alguses rakuretseptoritele seostumise eest.<ref name="Z21mo" /> Nukleokapsiid koosneb üheahelalisest positiivselt laetud [[RNA]]<nowiki/>st ja kapsiidivalkude koopiatest. Uuemad virioni rekonstruktsioonid näitavad, et virionil on ''T=4'' struktuur. [[Genoom|Genoomi]] pikkus on 11 703 [[Nukleotiidid|nukleotiidi]]. 5` otsas on [[müts -5´]] ja 3`otsas on [[polü(A)-saba]]. Genoom jaguneb kaheks peamiseks regiooniks: mittestruktuurseid valke (nsP1, nsP2, nsP3, nsP4) kodeeriv osa ja struktuurseid valke (E3, E2, 6K, E1 ja kapsiidivalk) kodeeriv osa. Mittestruktuursed valgud [[Translatsioon|transleeritakse]] RNA 5`terminuse poolselt kahelt kolmandikult ja struktuursed valgud ühelt kolmandikult.<ref name="strauss" /> |
|||
==Viiruse valgud== |
==Viiruse valgud== |
||
Sindbisi viirus kodeerib struktuurseid ja mittestruktuurseid valke. Struktuursed valgud kuuluvad virioni koostisse, kuid mittestruktuursed ei kuulu.<ref name="strauss" /> |
|||
=== Mittestruktuursed valgud === |
=== Mittestruktuursed valgud === |
||
Mittestruktuursete valkude hulka kuuluvad nsP1, nsP2, nsP3 ja nsP4. Neid seostatakse viiruse [[replikatsioon]]i |
Mittestruktuursete valkude hulka kuuluvad nsP1, nsP2, nsP3 ja nsP4. Neid seostatakse viiruse [[replikatsioon]]i<nowiki/>kompleksiga. Seega osalevad mittestruktuursed valgud viiruse [[RNA replikatsioon|RNA replikatsioonil]]. <ref name="understanding" /> |
||
Mittestruktuurseid valke transleeritakse genoomselt RNA-lt ja neid toodetakse kahest prekursor |
Mittestruktuurseid valke transleeritakse genoomselt RNA-lt ja neid toodetakse kahest prekursor-polüproteiinist, P123st ja P1234st. Polüproteiin P123 sisaldab nsp1-, nsP2- ja nsP3-järjestusi. P123 toodetakse, kui [[translatsioon]] termineerub mittestruktuurse avatud lugemisraami [[Opaalkoodon|opaalkoodonis]], nsP3 ja nsP4 vahel. Need polüproteiinid lõhutakse valmisproduktideks. Seda viib läbi nsP2s kodeeritud [[proteaas]]. NsP2 [[N-terminaalne ots|N-terminaalne]] domeen sisaldab nukleosiid-trifosfaati siduvat [[helikaas]]i motiivi. Nukleosiid-trifosfaatide hulka kuuluvad [[Adenosiintrifosfaat|ATP]] ja [[GTP]]. |
||
NsP1 on |
NsP1 on initsiatsioonifaktor RNA negatiivse ahela sünteesiks ja toimib [[metüültransferaas|metüültransferaasina]].<ref name="yukio" /> Metüültransferaasi toodetakse viirusega nakatunud [[Rakk|rakus]]. See on vastutav [[müts -5´]] metüleerimise eest.<ref name="strauss" /> Müts asub [[Informatsiooni-RNA|mRNA]] 5´-otsas. See sisaldab [[Guanosiin|guanosiini]]<nowiki/>nukleotiidi, mis on ühendatud mRNA külge trifosfaatidega. Metüültransferaas metüleerib guanosiini.<ref name="cap" /> Pärast seda on võimalik saadud produkt siduda [[Kovalentne side|kovalentselt]] nsP1ga.<ref name="understanding" />. Lisaks on müts vajalik selleks, et takistada [[Eksonukleaasid|eksonukleaase]] 5´-otsa lagundamast.<ref name="cap" /> NsP3 on kindlasti RNA sünteesi jaoks vajalik, kuid selle täpne funktsioon pole veel teada, sest sellel puudub spetsiifiline ensümaatiline aktiivsus.<ref name="yukio" /> |
||
Nsp3-l on kaks |
Nsp3-l on kaks selgelt eristuvat [[Domeen (struktuuribioloogia)|domeen]]i, N-terminaalne ja [[C-terminaalne ots|C-terminaalne]]. Neil kahel domeenil on viiruse replikatsioonis erinevaid rollid.<ref name="strauss" /> NsP3 C-terminaalne regioon kodeerib [[Seriin|seriine]] ja [[Treoniin|treoniine]], mida saab viiruses [[Fosforüülumine|fosforüüleerida]]. Vähenenud fosforülatsiooni korral toodetakse viiruses vähem negatiivse ahelaga RNA-d. |
||
NsP4 on viiruse RNA-st sõltuv RNA |
NsP4 on viiruse RNA-st sõltuv [[RNA polümeraas]]. Üksinda ei replitseeri nsP4 RNA-d. Arvatakse, et nsP4 sünteesib nii positiivse kui ka negatiivse ahelaga RNA-d. N-terminaalne regioon on vähe konserveerunud. N-terminaalselt lühendatud Sindbisi viiruse nsP4 evib adenüültransferaasi aktiivsust, mis võib olla seotud 3´-otsas asuva polü(A)-saba struktuuri sälitamisega.<ref name="understanding" /> |
||
=== Struktuursed valgud === |
=== Struktuursed valgud === |
||
Alfaviiruste struktuursed valgud transleeritakse subgenoomse RNA 26S |
Alfaviiruste struktuursed valgud transleeritakse subgenoomse RNA 26S-alamühikult. Seda töödeldakse posttranslatsiooniliselt ja kontranlatsiooniliselt ning tulemuseks saadakse viis individuaalset valku: E3, E2, 6K, E1 ja kapsiidivalk.<ref name="strauss" /><ref name="zhang" /> |
||
Kapsiidivalk on polüproteiinis N-terminaalne ja see toimib seriini proteaasina, mis osaleb iseenda autokatalüütilisel lõikamisel. Selle tulemusel vabastab kapsiidivalk iseennast vastsest polüpeptiidahelast. Pärast seda seostub kapsiidivalk lühiajaliselt [[ribosoom]]idega ja mõne minuti jooksul viiruse RNA-le ning paneb kiiresti kokku viiruspartiklid. Valgu seondumine viiruse RNA-le on oluline nukleokapsiidi moodustumise ja RNA sünteesi stimulatsiooni jaoks. Viimaks seostub nukleokapsiid E2 [[Tsütoplasma|tsütoplasmaatilise]] domeeniga [[Rakumembraan|rakumembraanil]]. See viib küpsete virionide moodustumiseni.<ref name="uniprot" /> |
|||
E1 ja E2 on [[glükoproteiin]]id, mis pannakse kokku [[heterodimeer]]ideks ning mida glükosüleeritakse ja transporditakse plasmamembraanile.<ref name="zhang" /> E2 ja E1 stabiilne heterodimeer säilib |
E1 ja E2 on [[glükoproteiin]]id, mis pannakse kokku [[heterodimeer]]ideks ning mida [[Glükosüleerimine|glükosüleeritakse]] ja transporditakse plasmamembraanile.<ref name="zhang" /> E2 ja E1 stabiilne [[Dimeer|heterodimeer]] säilib pärast viiruse dissotatsiooni puutumatuna ja kolm E1-E2-heterodimeeri interakteeruvad viiruse pinnal olevate piikidega. E1 ja E2 on kovalentselt seotud [[Palmitiinhape|palmithapetega]]. See on Sindbis viiruse ja SF-viiruse ainulaadne omadus alfaviiruste hulgas. Pärast viiruse ühinemist rakumembraaniga E1-E2-heterodimeer laguneb, et tõsta E2 monomeeride ja E1 homotrimeeride hulka. Piikides keerduvad kolm heterodimeeri ümber üksteise ning seejärel eralduvad.<ref name="strauss" /> E2 on vastutav viiruse kinnitumise eest sihtmärkrakule, seondudes raku pinnaretseptorile.<ref name="uniprot" /> |
||
P62 on [[prekursor]], mis lõigatakse E2ks ja E3ks.<ref name="strauss" /> P62 |
P62 on [[prekursor]], mis lõigatakse E2ks ja E3ks.<ref name="strauss" /> P62 toodetakse viimases etapis aravatavasti selleks, et ära hoida E1 liitumist rakupinnale enne viiruse lõpliku eksporti.<ref name="uniprot" /> P62-l on kaks membraani toestavat domeeni. Esimene on ankurdomeen glükoproteiini jaoks. Teine domeen sisaldab järjestust, mis on vajalik kapsiidivalgu spetsiifiliseks äratundmiseks.<ref name="Ug3T7" /> |
||
6K on |
6K on membraanivalk, mis on seotud viiruse glükoproteiini töötlemisega, rakku sisenemisega ja viiruspartiklite moodustumisega. 6K on väike [[Hüdrofoobsus|hüdrofoobne]] peptiid, mis aheldab E1 ja E2 ning mille C-terminaalne domeen käitub signaaljärjestusena E1 ümberpaiknemisel. 6K on samuti ühendatud palmithapetega.<ref name="strauss" /> Lisaks mõjutab see lipiidide selektsioone, mis interakteeruvad glükolipiidide transmembraansete domeenidega. See omakorda mõjutab [[Lipiidne kaksikkiht|kaksikkihi]] deformeeritavust. |
||
E1 on |
E1 on viiruse membraaniga liituv valk. Membraaniga liitumine ei saa toimuda, kui E1 on seotud E2ga. Pärast viiruse kinnitumist sihtmärkrakule ja [[endotsütoos]]i toimub E2-E1-heterodimeeri lagunemine ja E1 vabaneb. Nüüd on E1 aktiivne ja kutsub esile viirusliku nukleokapsiidi vabanemise tsütoplasmas pärast [[Endosoom|endosoomide]] ja viiruse membraani liitumist. Efektiivne liitumine nõuab [[Kolesterool|kolesterooli]] ja [[sfingolipiid]]ide olemasolu sihtmärkrakus.<ref name="uniprot" /> |
||
==Replikatsioon== |
==Replikatsioon== |
||
Alfaviiruste replikatsioon on mitmeastmeline ja asümmeetriline protsess. Replikatsiooni reguleerivad RNA |
Alfaviiruste replikatsioon on mitmeastmeline ja asümmeetriline protsess. Replikatsiooni reguleerivad RNA-elemendid ja [[Juuksenõelastruktuur|juuksenõelastruktuurid]]. Valdav osa RNA replikatsioonist sõltub mittestruktuursetest valkudest. Replikatsiooni mõjutavate RNA-elementide hulgas on 19 konserveerunud nukleotiidise järjestusega elementi (CSE). Need konserveerunud järjestused funktsioneerivad [[Promootor|promootorina]], mis on vajalik negatiivse ahela replikatsiooni alustamiseks. Replikatsiooni alustamiseks on vajalik RNA 5´- ja 3´-otste seondumine. |
||
Replikatsioon toimub kahes etapis. Esialgu kasutatakse viiruse RNA-d negatiivse ahela vaheprodukti sünteesi alusena. NsP4 ja P123 koos produtseerivad genoomse RNA negatiivse ahela koopia. Pärast seda funktsioneerib negatiivse ahela vaheprodukt positiivse ahela ja subgenoomse RNA produktsiooni alusena. Edaspidi sünteesitakse vaid positiivse ahelaga RNA-d, mis sisaldab nii genoomset kui ka subgenoomset RNA-d. |
|||
Peremeesraku valgud on |
Peremeesraku valgud on RNA replikatsioonil samuti olulised. On leitud, et nsP2, nsP3 ja nsP4 seonduvad peremeesraku valkudega. NsP4ga on ühenduses arginiini metüültransferaas, adeniini nukleotiidi translokaator ja [[Kuumašoki valk|kuumašoki valk 90]].<ref name="ncbi" /> <ref name="host" /> Ka struktuursed valgud on replikatsioonil vajalikud. On teada, et kapsiidivalk seondub spetsiifiliselt viiruse RNA-ga. See võib soodustada RNA replikatsiooni.<ref name="strauss" /> |
||
==Haiguslikud sümptomid ja ravi== |
==Haiguslikud sümptomid ja ravi== |
||
Sindbisi viirus nakatab inimesi, sääski ja [[Linnud|linde]]. Pole ühtegi tõendit selle kohta, et viirus oleks nakatanud teisi [[Imetajad|imetajaid]] peale inimeste. Viirus kuulub [[Arboviirused|arboviiruste]] hulka, mis tähendab, et viirust kantakse üle [[Lülijalgsed|lülijalgsetega]], Sindbisi viiruse puhul sääskedega. Tegemist on kõige laiemalt levinud arboviirusega.<ref name="medicine" /> |
|||
Inimestel on |
Inimestel on Sindbisi-viirusnakkus sageli isemööduv ja märkamatu. Infektsioon algab palaviku, kõhu- ja peavaluga. Akuutse faasi ajal on tüüpilisteks sümptomiteks [[artriit]], sügelev lööve, väsimus, kõrge palavik, lihas- ja peavalu. Lööve esineb kogu kehal ja jalgadel.<ref name="canada" /> Tekivad villid surve all olevatel kehaosadel, nagu jalatallad ja peopesad. Artriit tekib jäsemete liigestes. Mõnel inimesel võib viirus kulgeda krooniliselt. Sindbisi-viirusnakkust kutsutakse [[Rootsi|Rootsis]] Ockelbo haiguseks, [[Soome|Soomes]] Pogosta haiguseks ja [[Venemaa|Venemaal]] Karjala palavikuks. |
||
Esimesena kirjeldati |
Esimesena kirjeldati Sindbisi-viirusnakkuse sümptomeid [[Uganda]]s 1961. aastal. Sel ajal polnud [[Euroopa|Euroopas]], [[Aafrika|Aafrikas]], [[Aasia|Aasias]] ega [[Austraalia|Austraalias]] veel ühtegi teadaolevat Sindbisi viiruse nakkusjuhtumit. Euroopas isoleeriti Sindbisi viirust esimesena [[Itaalia|Itaalias]] 1975. aastal.<ref name="medicine" /> |
||
Sindbisi viiruse diagnoosimiseks kasutatakse [[IgM-antikeha|IgM-antikehade]] analüüsi. IgM-antikehad on veres leitavad esimese kaheksa päeva jooksul alates haigestumisest. Spetsiifilist ravimit pole, kuid on leitud aineid, mis inhibeerivad infektsiooni.<ref name="canada" /> Esimesena neist avastati [[klorokviin]]. Väikesed RNA-molekulid takistavad viiruse replikatsiooni. NsP1 on hea sihtmärk antiviraalsele teraapiale. Samuti on nsP3 hea sihtmärk viirusevastastele ühenditele.<ref name="understanding" /> |
|||
== Viited == |
== Viited == |
||
Redaktsioon: 14. märts 2020, kell 23:59
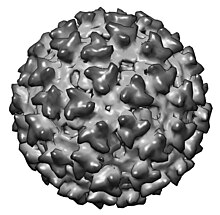
Sindbisi viirus kuulub Togaviridae sugukonda alfaviiruste perekonda.[1] Alfaviirused on geograafiliselt väga laialt levinud. Neid on leitud kõikidelt kontinentidelt.[2] Tegemist on sääskede kaudu leviva viirusega, mis põhjustab löövet ja artriiti. Sindbisi viirus tuvastati ja isoleeriti esimesena sääskedelt Niiluse jõe deltast Egiptuses 1952. aastal. Infektsioone on tuvastatud Põhja-Euroopas, Lõuna-Aafrikas, Austraalias, Hiinas ja Soomes.[3]
Struktuur
Sindbisi viiruse virioni ehitus on lihtne. Struktuursed teadmised viirusest põhinevad krüoelektronmikroskoopial ja röntgenkristallograafilistel analüüsidel.[4] Virion koosneb ikosaeedrilisest nukleokapsiidist, mida ümbritseb lipiidne ümbris. Ümbris koosneb kahest viiruslikust glükoproteiinist, E1st ja E2st. E2 vastutab peamiselt viirusinfektsiooni alguses rakuretseptoritele seostumise eest.[5] Nukleokapsiid koosneb üheahelalisest positiivselt laetud RNAst ja kapsiidivalkude koopiatest. Uuemad virioni rekonstruktsioonid näitavad, et virionil on T=4 struktuur. Genoomi pikkus on 11 703 nukleotiidi. 5` otsas on müts -5´ ja 3`otsas on polü(A)-saba. Genoom jaguneb kaheks peamiseks regiooniks: mittestruktuurseid valke (nsP1, nsP2, nsP3, nsP4) kodeeriv osa ja struktuurseid valke (E3, E2, 6K, E1 ja kapsiidivalk) kodeeriv osa. Mittestruktuursed valgud transleeritakse RNA 5`terminuse poolselt kahelt kolmandikult ja struktuursed valgud ühelt kolmandikult.[2]
Viiruse valgud
Sindbisi viirus kodeerib struktuurseid ja mittestruktuurseid valke. Struktuursed valgud kuuluvad virioni koostisse, kuid mittestruktuursed ei kuulu.[2]
Mittestruktuursed valgud
Mittestruktuursete valkude hulka kuuluvad nsP1, nsP2, nsP3 ja nsP4. Neid seostatakse viiruse replikatsioonikompleksiga. Seega osalevad mittestruktuursed valgud viiruse RNA replikatsioonil. [6]
Mittestruktuurseid valke transleeritakse genoomselt RNA-lt ja neid toodetakse kahest prekursor-polüproteiinist, P123st ja P1234st. Polüproteiin P123 sisaldab nsp1-, nsP2- ja nsP3-järjestusi. P123 toodetakse, kui translatsioon termineerub mittestruktuurse avatud lugemisraami opaalkoodonis, nsP3 ja nsP4 vahel. Need polüproteiinid lõhutakse valmisproduktideks. Seda viib läbi nsP2s kodeeritud proteaas. NsP2 N-terminaalne domeen sisaldab nukleosiid-trifosfaati siduvat helikaasi motiivi. Nukleosiid-trifosfaatide hulka kuuluvad ATP ja GTP.
NsP1 on initsiatsioonifaktor RNA negatiivse ahela sünteesiks ja toimib metüültransferaasina.[7] Metüültransferaasi toodetakse viirusega nakatunud rakus. See on vastutav müts -5´ metüleerimise eest.[2] Müts asub mRNA 5´-otsas. See sisaldab guanosiininukleotiidi, mis on ühendatud mRNA külge trifosfaatidega. Metüültransferaas metüleerib guanosiini.[8] Pärast seda on võimalik saadud produkt siduda kovalentselt nsP1ga.[6]. Lisaks on müts vajalik selleks, et takistada eksonukleaase 5´-otsa lagundamast.[8] NsP3 on kindlasti RNA sünteesi jaoks vajalik, kuid selle täpne funktsioon pole veel teada, sest sellel puudub spetsiifiline ensümaatiline aktiivsus.[7]
Nsp3-l on kaks selgelt eristuvat domeeni, N-terminaalne ja C-terminaalne. Neil kahel domeenil on viiruse replikatsioonis erinevaid rollid.[2] NsP3 C-terminaalne regioon kodeerib seriine ja treoniine, mida saab viiruses fosforüüleerida. Vähenenud fosforülatsiooni korral toodetakse viiruses vähem negatiivse ahelaga RNA-d.
NsP4 on viiruse RNA-st sõltuv RNA polümeraas. Üksinda ei replitseeri nsP4 RNA-d. Arvatakse, et nsP4 sünteesib nii positiivse kui ka negatiivse ahelaga RNA-d. N-terminaalne regioon on vähe konserveerunud. N-terminaalselt lühendatud Sindbisi viiruse nsP4 evib adenüültransferaasi aktiivsust, mis võib olla seotud 3´-otsas asuva polü(A)-saba struktuuri sälitamisega.[6]
Struktuursed valgud
Alfaviiruste struktuursed valgud transleeritakse subgenoomse RNA 26S-alamühikult. Seda töödeldakse posttranslatsiooniliselt ja kontranlatsiooniliselt ning tulemuseks saadakse viis individuaalset valku: E3, E2, 6K, E1 ja kapsiidivalk.[2][4]
Kapsiidivalk on polüproteiinis N-terminaalne ja see toimib seriini proteaasina, mis osaleb iseenda autokatalüütilisel lõikamisel. Selle tulemusel vabastab kapsiidivalk iseennast vastsest polüpeptiidahelast. Pärast seda seostub kapsiidivalk lühiajaliselt ribosoomidega ja mõne minuti jooksul viiruse RNA-le ning paneb kiiresti kokku viiruspartiklid. Valgu seondumine viiruse RNA-le on oluline nukleokapsiidi moodustumise ja RNA sünteesi stimulatsiooni jaoks. Viimaks seostub nukleokapsiid E2 tsütoplasmaatilise domeeniga rakumembraanil. See viib küpsete virionide moodustumiseni.[9]
E1 ja E2 on glükoproteiinid, mis pannakse kokku heterodimeerideks ning mida glükosüleeritakse ja transporditakse plasmamembraanile.[4] E2 ja E1 stabiilne heterodimeer säilib pärast viiruse dissotatsiooni puutumatuna ja kolm E1-E2-heterodimeeri interakteeruvad viiruse pinnal olevate piikidega. E1 ja E2 on kovalentselt seotud palmithapetega. See on Sindbis viiruse ja SF-viiruse ainulaadne omadus alfaviiruste hulgas. Pärast viiruse ühinemist rakumembraaniga E1-E2-heterodimeer laguneb, et tõsta E2 monomeeride ja E1 homotrimeeride hulka. Piikides keerduvad kolm heterodimeeri ümber üksteise ning seejärel eralduvad.[2] E2 on vastutav viiruse kinnitumise eest sihtmärkrakule, seondudes raku pinnaretseptorile.[9]
P62 on prekursor, mis lõigatakse E2ks ja E3ks.[2] P62 toodetakse viimases etapis aravatavasti selleks, et ära hoida E1 liitumist rakupinnale enne viiruse lõpliku eksporti.[9] P62-l on kaks membraani toestavat domeeni. Esimene on ankurdomeen glükoproteiini jaoks. Teine domeen sisaldab järjestust, mis on vajalik kapsiidivalgu spetsiifiliseks äratundmiseks.[10]
6K on membraanivalk, mis on seotud viiruse glükoproteiini töötlemisega, rakku sisenemisega ja viiruspartiklite moodustumisega. 6K on väike hüdrofoobne peptiid, mis aheldab E1 ja E2 ning mille C-terminaalne domeen käitub signaaljärjestusena E1 ümberpaiknemisel. 6K on samuti ühendatud palmithapetega.[2] Lisaks mõjutab see lipiidide selektsioone, mis interakteeruvad glükolipiidide transmembraansete domeenidega. See omakorda mõjutab kaksikkihi deformeeritavust.
E1 on viiruse membraaniga liituv valk. Membraaniga liitumine ei saa toimuda, kui E1 on seotud E2ga. Pärast viiruse kinnitumist sihtmärkrakule ja endotsütoosi toimub E2-E1-heterodimeeri lagunemine ja E1 vabaneb. Nüüd on E1 aktiivne ja kutsub esile viirusliku nukleokapsiidi vabanemise tsütoplasmas pärast endosoomide ja viiruse membraani liitumist. Efektiivne liitumine nõuab kolesterooli ja sfingolipiidide olemasolu sihtmärkrakus.[9]
Replikatsioon
Alfaviiruste replikatsioon on mitmeastmeline ja asümmeetriline protsess. Replikatsiooni reguleerivad RNA-elemendid ja juuksenõelastruktuurid. Valdav osa RNA replikatsioonist sõltub mittestruktuursetest valkudest. Replikatsiooni mõjutavate RNA-elementide hulgas on 19 konserveerunud nukleotiidise järjestusega elementi (CSE). Need konserveerunud järjestused funktsioneerivad promootorina, mis on vajalik negatiivse ahela replikatsiooni alustamiseks. Replikatsiooni alustamiseks on vajalik RNA 5´- ja 3´-otste seondumine.
Replikatsioon toimub kahes etapis. Esialgu kasutatakse viiruse RNA-d negatiivse ahela vaheprodukti sünteesi alusena. NsP4 ja P123 koos produtseerivad genoomse RNA negatiivse ahela koopia. Pärast seda funktsioneerib negatiivse ahela vaheprodukt positiivse ahela ja subgenoomse RNA produktsiooni alusena. Edaspidi sünteesitakse vaid positiivse ahelaga RNA-d, mis sisaldab nii genoomset kui ka subgenoomset RNA-d.
Peremeesraku valgud on RNA replikatsioonil samuti olulised. On leitud, et nsP2, nsP3 ja nsP4 seonduvad peremeesraku valkudega. NsP4ga on ühenduses arginiini metüültransferaas, adeniini nukleotiidi translokaator ja kuumašoki valk 90.[11] [12] Ka struktuursed valgud on replikatsioonil vajalikud. On teada, et kapsiidivalk seondub spetsiifiliselt viiruse RNA-ga. See võib soodustada RNA replikatsiooni.[2]
Haiguslikud sümptomid ja ravi
Sindbisi viirus nakatab inimesi, sääski ja linde. Pole ühtegi tõendit selle kohta, et viirus oleks nakatanud teisi imetajaid peale inimeste. Viirus kuulub arboviiruste hulka, mis tähendab, et viirust kantakse üle lülijalgsetega, Sindbisi viiruse puhul sääskedega. Tegemist on kõige laiemalt levinud arboviirusega.[13]
Inimestel on Sindbisi-viirusnakkus sageli isemööduv ja märkamatu. Infektsioon algab palaviku, kõhu- ja peavaluga. Akuutse faasi ajal on tüüpilisteks sümptomiteks artriit, sügelev lööve, väsimus, kõrge palavik, lihas- ja peavalu. Lööve esineb kogu kehal ja jalgadel.[14] Tekivad villid surve all olevatel kehaosadel, nagu jalatallad ja peopesad. Artriit tekib jäsemete liigestes. Mõnel inimesel võib viirus kulgeda krooniliselt. Sindbisi-viirusnakkust kutsutakse Rootsis Ockelbo haiguseks, Soomes Pogosta haiguseks ja Venemaal Karjala palavikuks.
Esimesena kirjeldati Sindbisi-viirusnakkuse sümptomeid Ugandas 1961. aastal. Sel ajal polnud Euroopas, Aafrikas, Aasias ega Austraalias veel ühtegi teadaolevat Sindbisi viiruse nakkusjuhtumit. Euroopas isoleeriti Sindbisi viirust esimesena Itaalias 1975. aastal.[13]
Sindbisi viiruse diagnoosimiseks kasutatakse IgM-antikehade analüüsi. IgM-antikehad on veres leitavad esimese kaheksa päeva jooksul alates haigestumisest. Spetsiifilist ravimit pole, kuid on leitud aineid, mis inhibeerivad infektsiooni.[14] Esimesena neist avastati klorokviin. Väikesed RNA-molekulid takistavad viiruse replikatsiooni. NsP1 on hea sihtmärk antiviraalsele teraapiale. Samuti on nsP3 hea sihtmärk viirusevastastele ühenditele.[6]
Viited
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 James H. Strauss ja Ellen G. Strauss "The alphaviruses:Gene expression, replication and evolution". (lk 492, 495, 498, 511). september 1994. Pasadena, California: Division of Biology, California Institute of Technology.
- ↑ Satu Kurkela, Osmo Rätti jt Sindbis Virus Infection in Resident Birds, Migratory Birds, and Humans, Finland. (lk 41). jaanuar 2008. Soome: Emerging Infectious Diseases.
- ↑ 4,0 4,1 4,2 Wei Zhang, Suchetana Mukhopadhyay jt. Placement of the Structural Proteins in Sindbis Virus. (lk 11645). 8. august 2002. West Lafayette, India: Department of Biological Sciences, Purdue University.
- ↑ Andrew P. Byrnes ja Diane E. Griffin. Binding of Sindbis Virus to Cell Surface Heparan Sulfate. (lk 7349). 26. veebruar 1998. Baltimore, Maryland: American Society for Microbiology, Journal of virology.
- ↑ 6,0 6,1 6,2 6,3 E.A Gould, B.Coutard jt. "Undestanding the alphaviruses: Recent research on important emerging pathogens and progess towards their control". (lk 117–121). 11. juuli 2009. United States: Antiviral research.
- ↑ 7,0 7,1 Yukio Shirako ja James H. Strauss. Regulation of Sindbis Virus RNA Replication: Uncleaved P123 and nsP4 Function in Minus-Strand RNA Synthesis, whereas Cleaved Products from P123 Are Required for Efficient Plus-Strand RNA Synthesis. (lk 1874–1875). 7. detsember 1993. Pasadena, California: Division of Biology, California Institute of Technology.
- ↑ 8,0 8,1 A.J Shatkin Capping of eukaryotic mRNAs. detsember 1976. Nutely, New Jersey: Roche Institute of molecular biology.
- ↑ 9,0 9,1 9,2 9,3 Uniprot. UniProtKB – P03316 (POLS_SINDV). Uniprot . (vaadatud 1. november 2015)
- ↑ The assembly of sindbis virus bichem.ncsu.edu. (vaadatud 1. november 2015)
- ↑ I. Frolov, R. Hardy ja C. M. Rice. Cis-acting RNA elements at the 5' end of Sindbis virus genome RNA regulate minus- and plus-strand RNA synthesis. (lk 1638–1639). 2001. USA: Cambridge University Press, RNA society.
- ↑ Ileana M. Cristea, Heather Rozjabek jt. Host Factors Associated with the Sindbis Virus RNA-Dependent RNA Polymerase: Role for G3BP1 and G3BP2 in Virus Replication. (lk 6720–6721). 4. aprill 2010. USA: American Society for Microbiology, Journal of Virology.
- ↑ 13,0 13,1 M. Laine, R. Luukainen ja A. Toivanen. Sindbis viruses and other alphaviruses as cause of human arthritic disease. (lk 457–461). 2004. Turku, Finland:Turku university, Journal of internationl medicine.
- ↑ 14,0 14,1 Public Health Agency of Canada. Sindbis virus – Pathogen Safety Data Sheet. (vaadatud 6. november 2015)
