Süsihappegaas


Süsihappegaas ehk süsinikdioksiid (CO2) on süsiniku stabiilseim oksiid, mille molekul koosneb ühest süsiniku ja kahest hapniku aatomist, mis on kovalentselt seotud süsiniku aatomiga.
Süsihappegaas tekib süsiniku ja selle mitmesuguste ühendite kuumutamisel piisava hulga hapnikuga, samuti hingamisel.
Taimed, vetikad ja tsüanobakterid seovad süsihappegaasi ja vett ning kasutavad valguse neeldumisel vabanevat energiat fotosünteesi käigus, et toota süsivesikuid, mille keemiline energia on suurem, kui CO2 molekulil. Selle protsessi kõrvalsaadusena eraldub molekulaarne hapnik. Pimedas fotosünteesi ei toimu, sellepärast kasutavad taimed pimedas vähe süsihappegaasi.
Süsihappegaas on põlemise kõrvalsaadus, mis eraldub näiteks vulkaanipursetel ja kuumaveeallikatest ehk geisritest. Süsihappegaasi eraldub ka karbonaatsete kivimite lõhustumisel.
Enne kui inimtegevus hakkas hulgaliselt süsihappegaasi atmosfääri paiskama, muutus süsinikdioksiidi kontsentratsioon vastavalt kliima muutumisele. See töötas vastu teistele muutustele, näiteks neile, mida põhjustasid orbitaaltsüklid. Põhjapoolkera kevade ja suve ajal süsihappegaasi kontsentratsioon väheneb, sest taimed kasutavad seda rohkem, ning tõuseb sealse sügise ja talve ajal, kui taimed on puhkeolekus, surevad ja lagunevad[1].
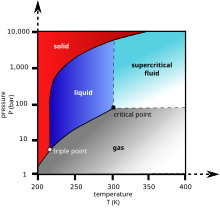
Süsihappegaasi kolmikpunkti rõhk on suurem atmosfäärirõhust. Atmosfäärirõhul sublimeerub süsihappegaas temperatuuril −78 °C. Kõrgemal rõhul see sulab: kriitiline punkt on 31 °C ja 73 atmosfääri. Süsihappegaas vedeldub alles 520 kPa rõhu juures. Tahkes olekus süsihappegaasi nimetatakse kuivjääks.
Süsihappegaas lahustub vees mõõdukal määral. Lahused on happelised süsihappe sisalduse tõttu, mis tekib süsihappegaasi ja vee reaktsioonil:
H2O + CO2 = H2CO3.
Süsihappegaasi leidub ka õhus. Maa atmosfääris on seda 0,039%.
Suures kontsentratsioonis on süsihappegaas inimestele mürgine. Õhk, mille koostises on 1% süsihappegaasi, teeb mõned inimesed uimaseks, 7–10% kontsentratsioon põhjustab peapööritust, peavalu, nägemis- ja kuulmishäireid ning mõne minuti või tunni jooksul teadvusekaotust[2].
Süsihappegaas on kasvuhoonegaas, sest laseb läbi nähtavat valgust, aga neelab infrapunakiirgust.
Keemilised ja füüsikalised omadused[muuda | muuda lähteteksti]
Süsihappegaas on värvitu, madala kontsentratsiooni korral ka lõhnatu gaas. Suure kontsentratsiooni korral on süsinikdioksiidil terav happeline lõhn. CO2 võib põhjustada lämbumist ja ärritust. Suure süsihappegaasisisaldusega õhu sissehingamine võib tekitada hapukat maitset suus ning torkivat tunnet ninas ja kurgus. Selline aisting võib tekkida ka röhitise tagasihoidmisel ja pärast karboniseeritud joogi joomist.
Standardrõhul ja -temperatuuril on süsihappegaasi tihedus 1,98 kg/m³, mis on 1,5 korda suurem õhu tihedusest. Süsinikdioksiidi molekulis on kaks kaksiksidet ja on lineaarse kujuga. See molekul ei sisalda elektridipoole ja on täielikult oksüdeeritud. Süsihappegaas on mõõdukalt aktiivne, kuid mitte süttiv, kuigi soodustab metallide põlemist.
Temperatuuril üle −78,51 °C sublimeerub süsihappegaas tahkest olekust gaasilisse, madalamal temperatuuril muutub tahkeks. Tahket süsinikdioksiidi nimetatakse kuivjääks (ka süsihappelumeks).
Kuiva jää avastas 1825. aastal prantsuse keemik Charles Thilorier. Kuiva jääd kasutatakse tihti jahutajana, see on suhteliselt odav. Väga mugav on asjaolu, et kuiva jää sublimeerumisel ei jää järele vedelikku, kuna see sublimeerub gaasiks. Seda kasutatakse laborites, transportimisel toiduainete säilitamisel ja laevanduses. Süsihappegaasi üks suurimaid kasutusalasid on survepesu.
Vedel süsinikdioksiid moodustub vaid rõhkudel, mis on suuremad kui 5,1 atm. Süsihappegaasi kolmikpunkt on umbes 518 kPa ja −56,6 °C ja kriitiline punkt on 7,83 MPa ja 31,3 °C juures.
Ajalugu[muuda | muuda lähteteksti]

Süsihappegaas oli üks esimesi gaase, mida kirjeldati õhust erineva ainena. 17. sajandil täheldas flaami keemik Jan Baptist van Helmont, et puusöe põletamisel kinnises anumas on järelejääva tuha mass väiksem kui algse söe mass. Tema tõlgendus oli, et ülejäänud süsi muutus nähtamatuks aineks või gaasiks.
Süsinikdioksiidi omadusi uuris põhjalikumalt 1750. aastatel šoti füüsik Joseph Black. Ta leidis, et lubjakivi (kaltsiumkarbonaadi) kuumutamisel ja hapetega töötlemisel saab toota süsihappegaasi. Ta leidis, et see gaas on õhust tihedam ning ei soodusta põlemist ega hingamist. Black avastas ka, et kui lasta süsihappegaasi läbi lubja (kaltsiumhüdroksiidi) vesilahuse, sadestub selle tulemusena kaltsiumkarbonaat. Katseliselt näitas ta, et süsihappegaas vallandub hingamisel ja mikroobsel kääritamisel.
1772. aastal avaldas inglise keemik Joseph Priestly artikli „Vee rikastamine fikseeritud õhuga“ („Impregnating water with Fixed Air“), milles ta kirjeldas protsessi, kus tilgutati väävelhapet kriidile, et saada süsihappegaasi, ja sunniti saadud gaas lahustuma kausitäies vees[3]. Nii leiutati karboniseeritud vesi.
Esimest korda viisid süsinikdioksiidi vedelasse olekusse (kõrgendatud rõhul) 1832. aastal Humphry Davy ja Michael Faraday.[4]
Esimesena kirjeldas tahket süsihappegaasi Charles Thilorier, kes 1834. aastal avas rõhu all hoitud süsihappegaasi mahuti ja leidis, et kiire aurustumise tõttu toimunud jahutamisel oli tekkinud CO2 lumi.[5]

Esimesena seostas süsihappegaasi atmosfääris osakaalu suurenemise ja planeedi soojenemise Eunice Newton Foote 1856. aastal.[6]
Eraldamine ja tootmine[muuda | muuda lähteteksti]
Süsihappegaasi saab toota õhu destilleerimisel, kuigi see meetod pole eriti tõhus. Tuntakse mitut keemilist reaktsiooni, mille tulemusena on võimalik saada süsinikdioksiidi. Sellised on reaktsioonid enamiku hapete ja metallide karbonaatide vahel. Näiteks soolhappe ja kaltsiumkarbonaadi vahel toimub järgmine reaktsioon:
- 2 HCl+ CaCO3 → CaCl2 + H2CO3
Süsihape laguneb edasi veeks ja CO2-ks. Sellised reaktsioonid kaasnevad vahutamise või mullitamisega. Tööstuses on taolised reaktsioonid laialt levinud, nendega saab neutraliseerida jääkhappe vooge.
Kustutamata lubja tootmine lubjakivist kuumutamisel 850 °C-ni toodab ka CO2:
CaCO3 → CaO + CO2
Kõigi süsinikku sisaldavate kütuste nagu metaani, bensiini, diisli, propaani, aga ka kivisöe ja puidu põlemine annab süsihappegaasi ning enamikul juhtudel vett. Näitena on toodud metaani ja hapniku vaheline reaktsioon:
CH4 + 2 O2 → CO2 + 2 H2O
Raua redutseerimisel nt raud(II) oksiidist koksi abil kõrgahjus kuumutades on tulemuseks malm ja süsihappegaas[7]:
Fe2O3 + 3 CO → 2 Fe + 3 CO2
Suhkrust saab pärmiga reageerides metabolismi tõttu süsihappegaas ja etanool, mida tuntakse alkoholina õllepruulimisel, veini ja muude vägijookide tegemisel, aga mida kasutatakse ka biokütuse tootmisel.
C6H12O6 → 2 CO2 + 2 C2H5OH
Kõik aeroobsed organismid toodavad süsihappegaasi, kui nad oksüdeerivad rakkude mitokondrites süsivesikuid, rasvhappeid ja proteiine. Need arvukad rakus toimuvad reaktsioonid on keerulised ja raskesti kirjeldatavad (raku hingamine, anaeroobne hingamine ja fotosüntees). Fototroofid (nt taimed, tsüanobakterid) kasutavad teistsugust toimimisviisi. Taimed seovad õhust süsihappegaasi ja koos veega toodavad sellest süsivesikuid.
nCO2 + nH2O → (CH2O)n + nO2
Süsinikdioksiid lahustub vees, kus see spontaanselt muutub süsihappegaasist süsihappeks ja vastupidi. CO2 ja H2CO3 suhtelised kontsentratsioonid ja vähemaprootonilised vormid HCO3- (vesinikkarbonaat) ja CO23- (karbonaat) sõltuvad pH-st (happelisusest). Neutraalses või kergelt aluselises vees (pH<6,5) domineerib vesinikkarbonaat (>50%), valdavaks (>95%) muutub see merevee pH juures. Väga aluselises vees (pH>10,4) domineerib karbonaat. Vesinikkarbonaatsed ja karbonaatsed vormid lahustuvad väga hästi, näiteks õhuga tasakaalustatud ookeanivees (kergelt aluseline, tavaline pH = 8,2 – 8,5) on 120 mg vesinikkarbonaati liitri kohta.

Tööstuslik tootmine[muuda | muuda lähteteksti]
Tööstuslikult toodetakse süsihappegaasi peamiselt viie protsessiga:
- otse looduslikest süsihappegaasi allikatest, kus see tekib happelise vee toimel lubjakivile või dolomiidile
- kõrvalsaadusena vesinikku tootvates tehastes, kus metaan muudetakse CO2-ks
- fossiilkütuste või puidu põletamisel
- suhkru kääritamisel õllepruulimisel või muude alkohoolsete jookide valmistamisel
- lubjakivi (CaCO3) termilisel lõhustamisel, lubja (kaltsiumoksiidi, CaO) valmistamisel.
Kasutusalad[muuda | muuda lähteteksti]
Süsihappegaasi kasutatakse toiduainetööstuses, õlitööstuses ja keemiatööstuses. Seda kasutatakse paljudes tarbetoodetes, kus on vaja rõhu all gaasi, kuna see on odav ja mittesüttiv. Kuna süsihappegaas läheb gaasilisest olekust vedelasse toatemperatuuril 60-baarise rõhu all, mahutab anum palju süsihappegaasi. Päästevestides on sageli rõhu all süsihappegaasi kapslid, et vesti täis pumpamine toimuks kiiresti. Alumiiniumist CO2 kapsleid müüakse kokkusurutud gaasivarudena. Neid kapsleid kasutatakse õhupüstolites, paintballi püstolites, täispuhutavates jalgrattakummides ja karboniseeritud vee tegemisel. Vedela süsinikdioksiidi ülikiiret aurustumist kasutatakse kivisöekaevandustes lõhkamiseks. Kõrget süsinikdioksiidi kontsentratsiooni saab kasutada ka kahjurite tapmiseks ja taimekasvu kiirendamiseks. Vedelat süsinikdioksiidi kasutatakse toiduainete ja materjalide superkriitilisel kuivatamisel, skaneeriva elektronmikroskoopia näidiste valmistamisel ja kohviubade kofeiinist puhastamisel.
Toidud[muuda | muuda lähteteksti]
Süsihappegaas on toidulisand, mida kasutatakse toiduainete tööstuses isutekitajana ja happesuse regulaatorina. Selle kasutamine on heaks kiidetud Euroopa liidus (E arvuna E 290)[8], Ameerika Ühendriikides[9], Austraalias ja Uus-Meremaal[10] (INS numbri järgi 290). Komm Pop Rocks on kokku surutud süsihappegaasiga umbes 40 baari juures. Suhu pannes see lahustub ja vallandab gaasi kuuldava plõksuga.
Kergitusained toodavad süsihappegaasi, et tainast kergitada. Pagaripärm toodab süsinikdioksiidi suhkru kääritamisega tainas. Keemilised kergitajad, näiteks küpsetuspulber ja sooda, vallandavad süsihappegaasi kokkupuutel happega või kuumutades.
Joogid[muuda | muuda lähteteksti]
Süsihappegaasi kasutatakse karastusjookide ja karboniseeritud vee valmistamisel. Traditsiooniliselt on õlles ja veinides sisalduv gaas pärit looduslikust käärimisest. Paljud tootjad karboniseerivad neid jooke kääritamisest saadud CO2-ga. Pudeli- ja vaadiõlle puhul on CO2 taaskasutamine kõige tavapärasem meetod.
Kuivjää vormis süsihappegaasi kasutatakse sageli veinitegemisel viinamarjakobarate kiireks jahutamiseks pärast korjamist, et ära hoida spontaanset käärimist looduslike pärmide tõttu. Peamine eelis kuivjää kasutamisel tavalise vee ees on, et sellest ei jää viinamarjade juurde lisavett, mis vähendaks viinamarjasuhkru ja alkoholi kontsentratsiooni veinis. Kuivjääd kasutatakse viinamarjade jahutamiseks. Süsihappegaas, mis tekib kuivjääst sublimatsiooni tõttu, settib paagi põhja, kuna on õhust raskem. Settinud süsinikdioksiid tekitab hapnikuvaese keskkonna, mis aitab ära hoida bakterite kasvamise viinamarjadel, kuni on aeg alustada kääritamisprotsessi soovitud pärmisordiga.
Loomade hukkamisel[muuda | muuda lähteteksti]
Süsihappegaasi võidakse kasutatakse loomade massilisel haigestumise korral, näiteks kodusigade nakatumisel sigade Aafrika katku viirusega ja/või haigestumisel sigade Aafrika katku, nende massiliseks hukkamiseks.[11]
Suruõhusüsteemid[muuda | muuda lähteteksti]
Süsihappegaas on levinud gaas, mida kasutatakse sururõhuseadmetes ja võitlusrobotites.
Tulekustuti[muuda | muuda lähteteksti]
Süsihappegaas summutab leegid. Tulekustutid, mis on mõeldud elektrist põhjustatud tulekahjude kustutamiseks, sisaldavad suure rõhu all vedelat süsihappegaasi. Süsinikdioksiidi kustutid töötavad hästi väikeste tuleohtlike vedelike ja elektritulekahjude korral, aga mitte tavaliste põlengute puhul, kuna see on kuiv. Süsinikdioksiidi on laialdaselt kasutatud kustutusvahendina kinnistes kustutussüsteemides kindla ohu vältimiseks ja kaitstava ala katmiseks. Rahvusvahelise Merendusorganisatsiooni standardid tunnustavad süsihappegaasi süsteeme sobilikuks kasutamisel laevaruumides ja mootoriruumides. Süsihappegaasipõhiseid kaitsesüsteeme on seotud mitmete surmadega, kuna kustutamiseks kasutatavad kontsentratsioonid on tervisele kahjulikud, kuigi neid ei peeta inimesele mürgiseks.
Keevitamine[muuda | muuda lähteteksti]
Süsihappegaasi kasutatakse ka keevitamise keskkonnana, kuigi keevituskaares toimib see metallide oksüdeerijana.
Farmatseutiline ja keemiline töötlus[muuda | muuda lähteteksti]
Vedel süsinikdioksiid on hea lahusti orgaanilistele rasvaühenditele ja seda kasutatakse kohvist kofeiini eemaldamiseks. Süsihappegaas on farmaatsias äratanud tähelepanu vähem mürgise alternatiivina levinud lahustitele nagu klooritud süsivesinikud. Seetõttu kasutatakse seda mõnel pool keemilises puhastuses.
Kasvuhooned[muuda | muuda lähteteksti]
Süsinikdiioksiidi kasutatakse kasvuhoonetes taimede kasvu kiirendajana. Süsihappegaasiga "väetamiseks" tõstetakse kasvuhoonetes süsihappegaasi sisaldus 600 ppm kuni 1000 ppm -ini, mille tulemusel tõuseb gaasimüüjate andmetel tomati, kurgi ja lehtsalati saagikus 25-30%, kohati isegi rohkem.
Süsihappegaas keskkonnas[muuda | muuda lähteteksti]
 Pikemalt artiklis Süsihappegaasi emissioon
Pikemalt artiklis Süsihappegaasi emissioon
Atmosfäär on maakera suurim süsinikdioksiidi hoidla ja selle kanda on väga oluline osa üleilmsest süsinikuringest. Atmosfääri koostises on 0,04% CO2, mis on mahulises arvestuses umbes 720 gigatonni. Atmosfääri süsinik on oluline tegur kasvuhooneefekti tekkes ja põhjustab muutusi globaalses kliimas. Alates tööstusrevolutsioonist on CO2 kontsentratsioon atmosfääris tõusnud tasemelt 280 ppm kuni väärtuseni 400 ppm.
Kuna CO2 lahustub vees, siis on kasvanud ka selle kontsentratsioon ookeanides. See põhjustab merevee keemiliste omaduste muutumist ning kutsub esile maailmamere hapestumist (vee pH taseme langust). Muutused vee keemilistes omadustes võivad põhjustada tõsiseid tagajärgi lubiskeletiga organismidele.
Vaata ka[muuda | muuda lähteteksti]
Viited[muuda | muuda lähteteksti]
- ↑ Enting, I.G., 1987: Interannual variation in the seasonal cycle of carbon dioxide concentration at Mauna Loa. Journal of Geophysical Research 92:D5, 5497–5504
- ↑ "Carbon Dioxide as a Fire Suppressant: Examining the Risks". U.S. Environmental Protection Agency:.
{{cite news}}: CS1 hooldus: üleliigsed kirjavahemärgid (link) - ↑ Priestley, Joseph; Hey, Wm (1772). "Observations on Different Kinds of Air". Philosophical Transactions. 62 (0): 147–264. DOI:10.1098/rstl.1772.0021.
- ↑ Davy, Humphry (1823). "On the Application of Liquids Formed by the Condensation of Gases as Mechanical Agents". Philosophical Transactions (PDF). 113 (0): 199–205. DOI:10.1098/rstl.1823.0020.
{{cite journal}}:|format=nõuab parameetrit|url=(juhend) - ↑ Duane, H.D. Roller; Thilorier, M. (1952). "Thilorier and the First Solidification of a "Permanent" Gas (1835)". Isis. 43 (2): 109–113. DOI:10.1086/349402.
- ↑ "Eleni Dovrou about climate pioneer Eunice Newton Foote". Max-Planck-Gesellschaft. 20. veebruar 2023. Vaadatud 26. märtsil 2023.
- ↑ Strassburger, Julius (1969). Blast Furnace Theory and Practice. New York: American Institute of Mining, Metallurgical, and Petroleum Engineers. ISBN 0677104200.
- ↑ UK Food Standards Agency: "Current EU approved additives and their E Numbers". Vaadatud 27.10.2011.
- ↑ US Food and Drug Administration: Food Additive Status List
- ↑ Australia New Zealand Food Standards Code"Standard 1.2.4 – Labelling of ingredients". Vaadatud 27.10.2011.
- ↑ Maarius Suviste, Seakatk võimutseb: päevaga langes ohvriks kaks farmi, 31. juuli 2015, veebiversioon (tarve 31.07.2015)
| Pildid, videod ja helifailid Commonsis: Süsihappegaas |
| Tsitaadid Vikitsitaatides: Süsihappegaas |
