Karbapeneemid: erinevus redaktsioonide vahel
Sacerdos79 (arutelu | kaastöö) Resümee puudub |
Resümee puudub |
||
| 8. rida: | 8. rida: | ||
== Toimemehhanism == |
== Toimemehhanism == |
||
Karbapeneemide toimemehhanism on sarnane penitsilliinide omale. Karbapeneemid põhjustavad bakterite lüüsi, kuna inhibeerivad bakteriaalse rakuseina sünteesi, seostudes penitsilliini siduvate [[valgud|valkudega]]. Bakterite [[rakk|raku]] lüüsi ning rakuseina lagunemise käigus indutseerivad karbapeneemid [[endotoksiin]]ide vabanemist. Erinevalt teistest beetalaktaam ühenditest vabaneb karbapeneemide antibakteriaalse toime käigus |
Karbapeneemide toimemehhanism on sarnane penitsilliinide omale. Karbapeneemid põhjustavad bakterite lüüsi, kuna inhibeerivad bakteriaalse rakuseina sünteesi, seostudes penitsilliini siduvate [[valgud|valkudega]]. Bakterite [[rakk|raku]] lüüsi ning rakuseina lagunemise käigus indutseerivad karbapeneemid [[endotoksiin]]ide vabanemist. Erinevalt teistest beetalaktaam ühenditest vabaneb karbapeneemide antibakteriaalse toime käigus oluliselt väiksem kogus bakteriaalset endotoksiini s.o. mürki, mis mõnedel kriitiliselt haigetel patsientidel põhjustab septilise [[šokk|šoki]]. Endotoksiin mängib olulist rolli septilise šoki [[patogenees]]is gramnegatiivsete bakteriaalsete infektsioonide korral. Septiline šokk ja endotokseemia võivad esineda gramnegatiivsete infektsioonide ravil antibiootikumidega, seejuures antibiootikumid suurendavad endotoksiinide vabanemist, mis võib omakorda olla seotud halveneva kliinilise seisundiga. Bakteriaalse endotoksiini vabanemise vähese indutseerimise seisukohalt on karbapeneemid kliinilises kasutuses väga sobivad.<ref name="okereke"/> |
||
== Näited == |
== Näited == |
||
Redaktsioon: 16. veebruar 2012, kell 00:20


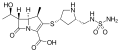
Karbapeneemid on beetalaktaam-antibiootikumid, mis on aktiivsed nii grampositiivsete kui gramnegatiivsete organismide suhtes. Karbapeneemid on üha enam kasutusel infektsioonide ravimisel kriitiliselt haigete patsientide puhul. Neid rakendatakse iseseisvalt või aminoglükosiidide ja vankomütsiini kaasabil. Karbapeneemid on stabiilsed laiatoimelised antibiootikumid, mis on aktiivsed ka monoravina.[1]
Karbapeneem-antibiootikumid on tienamütsiini derivaadid, mis saadakse peneemi (penitsilliini ja tsefalosporiini struktuuride hübriid) molekuli struktuuri modifitseerimisel: väävel positsioonis 1 on asendatud süsinikuga ning viie-aatomilises tsüklis on 2. ja 3. süsiniku vahel kaksikside. [1]
Karbapeneemid omavad eeliseid teiste ravimite ees: aminoglükosiidide puhul on probleeme toksilisusega, nii aminoglükosiididel kui monobaktaamidel on kitsas toimespekter gramnegatiivsete organismide suhtes, penitsilliinid on ebastabiilsed, vajades inhibiitorit, mis kaitseks neid bakteriaalsete hüdrolüütiliste ensüümide toime eest. [1]
Toimemehhanism
Karbapeneemide toimemehhanism on sarnane penitsilliinide omale. Karbapeneemid põhjustavad bakterite lüüsi, kuna inhibeerivad bakteriaalse rakuseina sünteesi, seostudes penitsilliini siduvate valkudega. Bakterite raku lüüsi ning rakuseina lagunemise käigus indutseerivad karbapeneemid endotoksiinide vabanemist. Erinevalt teistest beetalaktaam ühenditest vabaneb karbapeneemide antibakteriaalse toime käigus oluliselt väiksem kogus bakteriaalset endotoksiini s.o. mürki, mis mõnedel kriitiliselt haigetel patsientidel põhjustab septilise šoki. Endotoksiin mängib olulist rolli septilise šoki patogeneesis gramnegatiivsete bakteriaalsete infektsioonide korral. Septiline šokk ja endotokseemia võivad esineda gramnegatiivsete infektsioonide ravil antibiootikumidega, seejuures antibiootikumid suurendavad endotoksiinide vabanemist, mis võib omakorda olla seotud halveneva kliinilise seisundiga. Bakteriaalse endotoksiini vabanemise vähese indutseerimise seisukohalt on karbapeneemid kliinilises kasutuses väga sobivad.[1]
Näited
Puudused
Ravimid ja kesknärvisüsteem
Karbapeneemid on soovitatud doosides kasutamisel võrdlemisi ohutud. Antud ravimite rakendamist piirab aga jätkuvalt beetalaktaam-antibiootikumide ning kitsamalt karbapeneemide (eriti imipeneemi) teraapias esinev krampide tekke oht. Antimikrobiaalses ravis võib enamiku antibiootikumide korral doosi tõstmine tuua kaasa ravimi suurenenud efektiivsuse. Imipeneemi/tsilastatiini uurimisel leiti aga tugev seos ülemäärase doosi ja krampide esinemise sageduse vahel. Uuemate ravimite meropeneemi ja ER-35786 korral on väiksem soodumus krampide tekkeks, nagu ilmnes loomkatsetest pentüleentetrasooliga. Teised karbapeneemidest põhjustatud mürgistused, mida loomkatsetes täheldati, on vere düskraasia, ülitundlikkuse reaktsioonid ja kardiovaskulaarsed hälbed. [1]
Raviminteraktsioonid
Olulist raviminteraktsiooni on täheldatud mitme karbapeneem-antibiootikumi (meropeneem, panipeneem, imipeneem) ja valproehappe vahel. [2] Valproehape on levinud ravim nii ravim-indutseeritud, kui muudel põhjustel tekkinud krambihoogude korral. [1] Rakendades antud antibiootikumide klassi ravimeid patsientidele, kellele manustatakse samaaegselt valproehapet, langevad valproehappe seerumi kontsentratsioonid allapoole ravikontsentratsioone. Karbapeneem-antibiootikumi ja valproehappe samaaegsel kasutamisel võib seega kaduda kontroll krambihoogude esinemise üle. Karbapeneem-antibiootikumi tarvitamise katkestamisel taastuvad manustatud valproehappe kontsentratsioonid organismis endisele tasemele.[2]
Resistentsus
Globaalselt esile tõusnud resistentsus antibiootikumidele on kannustatud laiaspektriliste antibiootikumide ulatuslikust kasutamisest, mis tekitab pideva selektiivse surve bakteritele. Samuti mängib rolli puudulik infektsioonide kontrolli all hoidmine, võimaldades nii patsientidevahelist edasikandumist ning resistentsete patogeenide säilimist keskkonnas. Võrreldes infektsioonidega, mida põhjustavad tundlikud vormid, kaasneb resistentsete organismide puhul suurem haigestumus ja suremus, pikem haiglaravi ning suuremad kulud.[3]
Bakteritel tekib antibiootikumide suhtes resistentsus kas geneetilise mutatsiooni tagajärjel või teistelt bakteritelt resistentse geenide omandamisel. Bakteriaalse resistentsuse kiire areng ja levik on muutmas pea kõik beetalaktaam-antibiootikumid iganenuks. Bakteriaalse resistentsuse peamine põhjus beetalaktaam- antibiootikumide suhtes on beetalaktamaasid. Bakterid võivad hakata beetalaktamaasi sünteesima antibiootikumide pideval esinemisel organismis. [4]
Probleemi ületamiseks on erinevaid strateegiaid. Üks lähenemine hõlmab beetalaktaam-antibiootikumi kontsentratsiooni suurendamist, arendades välja bakteriaalsetele ensüümidele toimivad klassikalised inhibiitorid, mida koos antibiootikumidega kasutada. Teine lahendus põhineb tõhusamate laiaspektriliste ühendite väljatöötamisel kasutamiseks monoravis. Sedasi on välja töötatud mitmeid generatsioone penitsilliine. Need ühendid hõlmavad tsefaame (tsefalosporiinid) ja tienamütsiin (karbapeneem) antibiootikume, mis kõik põhinevad peneemi molekuli modifikatsioonidel. [1]
Karbapeneemid on stabiilsed mitmete beetalaktamaaside suhtes, kuid on jätkuvalt labiilsed metallo-beetalaktamaaside toimele. Metallo-beetalaktamaasid kujutavad märkimisväärset ohtu beetalaktaamidel põhinevale ravile, olles viimase kümnendi vältel muutunud vastavalt epideemiliseks või endeemiliseks Kaug-Idas, Euroopas ja Lõuna-Ameerikas.[5]
Kasutamise tõhustamine
Antimikroobse resistentsuse kasvav sagedus on vähendamas raskete infektsioonide raviks sobivate antibiootikumide arvu. Kuna viimase kahekümne aasta jooksul on välja töötatud vaid mõned uued toimeained, on oluline olemasolevaid antibiootikume võimalikult efektiivselt kasutada, maksimeerides kliinilist potentsiaali, samas minimeerides resistentsuse väljakujunemise kiirust. Tähtsamad võtted säilitamaks sel moel karbapeneemide tõhusust on farmakokineetiliste/farmakodünaamiliste põhimõtete rakendamine, doseerimisrežiimi kohandamine või antibiootikumide rotatsiooni kasutamine.[3]
Farmakokineetilised/farmakodünaamilised põhimõtted
Farmakokineetiliste põhimõtete asjakohane rakendamine antimikrobiaalsel doseerimisel võimaldab optimeerida antimikrobiaalse mõjustamise aega, parandada kliinilisi ja mikrobioloogilisi tulemusi ja aeglustada antimikrobiaalse resistentsuse teket. Ideaalne antibiootikumi doseerimise strateegia tähendaks ravimdoosi, mis on piisav, et tagada suur tõenäosus bakterorganismi surmamiseks, kuid samas mürgistuse oht patsiendile oleks minimaalne[küsitav]. Optimaalne doseerimine vähendab ühtlasi tõenäosust, et raviva toimeaine selektiivse surve mõjul domineerib bakterpopulatsioonis resistente kloon.[3]
Doseerimisstrateegiad
Antibakteriaalsed toimeained varieeruvad suuresti antimikrobiaalse toime aja poolest ning need erinevused farmakodünaamilises aktiivsuses on abiks optimaalse doseerimisrežiimi määramisel. Karbapeneeme iseloomustatakse kui kontsentratsiooni- või aja-sõltuvuslikke antibiootikume, samas on üldiselt tunnustatud, et nende aktiivsus tuleneb esmatähtsana antibiootikumi kontsentratsiooni püsimisest üle minimaalse[küsitav] inhibeeriva kontsentratsiooni pikema aja jooksul.[3]
Ravimi mõju saab maksimeerida suurendades doosi, tõstes manustamise sagedust või pikendades infuseerimise kestust. Farmakokineetilised ja farmakodünaamilised teadustööd on uurinud uusi doseerimisrežiime ning ehkki need ei ole karbapeneemide jaoks veel litsentseeritud, näib nende rakendamine paljulubav.[3]
Antibiootikumide rotatsioon
Antibiootikumide rotatsiooni on pakutud ühe moodusena resistentsuse vähendamiseks. See lähenemine põhineb hüpoteesil, et määratud ajaperioodi vältel antibiootikumi või antibiootikumide klassi kasutamise katkestamine piirab antibiootilist survet kui stiimulit antibiootilise resistentsuse tekkeks.[3]
Viited
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Okereke, C. S. (2000). "Advances in the use of carbapenem antibiotics in the management of serious bacterial infections in special patient populations. I: Safety and efficacy in children and elderly patients". Current Therapeutic Research. 61 (5): lk. 289–320. DOI:10.1016/S0011-393X(00)80020-X.
{{cite journal}}: eiran tundmatut parameetrit|month=(juhend) - ↑ 2,0 2,1 Matthews, S. J., Lancaster, J. W. (2009). "Doripenem monohydrate, a broad-spectrum carbapenem antibiotic". Clinical Therapeutics. 31 (1): lk. 42–63. DOI:10.1016/j.clinthera.2009.01.013.
{{cite journal}}: eiran tundmatut parameetrit|month=(juhend)CS1 hooldus: mitu nime: autorite loend (link) - ↑ 3,0 3,1 3,2 3,3 3,4 3,5 Masterton, R. G. (2009). "The new treatment paradigm and the role of carbapenems". International Journal of Antimicrobial Agents. 33 (2): lk. 105.e1-105.e8. DOI:10.1016/j.ijantimicag.2008.07.023.
{{cite journal}}: eiran tundmatut parameetrit|month=(juhend) - ↑ Hakimelahi, G. H., Moosavi-Movahedia, A. A., Sabourya, A. A., Osetrovb, V., Khodarahmic, G. A., Shiad, K.-S. (2005). "The Carbapenem-based prodrugs. Design, synthesis, and biological evaluation of carbapenems". European Journal of Medicinal Chemistry. 40 (4): lk. 339–349. DOI:10.1016/j.ejmech.2004.11.002.
{{cite journal}}: eiran tundmatut parameetrit|month=(juhend)CS1 hooldus: mitu nime: autorite loend (link) - ↑ Jones, R. N., Sadera, H. S., Fritsche, T. R. (2005). "Comparative activity of doripenem and three other carbapenems tested against Gram-negative bacilli with various β-lactamase resistance mechanisms". Diagnostic Microbiology and Infectious Disease. 52 (1): lk. 71–74. DOI:10.1016/j.diagmicrobio.2004.12.008.
{{cite journal}}: eiran tundmatut parameetrit|month=(juhend)CS1 hooldus: mitu nime: autorite loend (link)