Paramagnetism
See artikkel ootab keeletoimetamist. |
Ülevaateks vaata Magnetism.


Paramagnetism on magnetismi vorm, mille korral paramagnetilises aines paardumata, samasuunalise spinniga valentselektronid orienteeruvad välises magnetväljas magnetväljaga samas suunas ning seega võimendavad seda. Nähtus on vastupidine diamagnetilisele ainele, mis välisesse välja asetatuna nõrgendab välist magnetvälja.[1] Paramagnetilistel ainetel on suhteline magnetiline läbitavus suurem või võrdne ühega (st magnetiline vastuvõtlikkus on positiivne), seetõttu nad tõmbuvad magnetväljaga. Välise välja poolt indutseeritud magnetmoment on väljatugevusega lineaarne ja seetõttu suhteliselt nõrk. Magnetmomendi tuvastamiseks on tarvis tundlikku ja analüütiliselt tasakaalustatud mõõtevahendit. Tänapäeval kasutatakse paramagnetiliste materjalide uurimiseks tihti SQUID-magnetomeetrit.
Paramagnetilistel materjalidel on väike, positiivne vastuvõtlikkus magnetväljadele. Magnetväli tõmbab sellist materjali enda poole, kuid pärast magnetvälja eemaldamist ei säili sellises aines magnetilised omadused. Paramagnetilisi omadusi põhjustavad paardumata elektronid ja välise magnetvälja poolt orienteeritud elektronid. Paramagnetiliste ainete hulka kuuluvad näiteks magneesium, molübdeen, hapnik, liitium ja tantaal.
Võrreldes ferromagnetitega ei säili paramagnetites magnetiseeritust välise magnetvälja puudumisel, sest sisemise soojusliikumise tõttu orienteeruvad elektronide spinnid korrapäratult ümber. Mõned paramagneetikud säilitavad spinnide ebakorrapärase orienteerituse absoluutsel nulltemperatuuril, seega on nad põhiolekus paramagnetilised. Seetõttu kogu magnetiseeritus langeb nulli kui väline magnetväli eemaldada. Välja olemasolul toimub väga vähene indutseeritud magnetiseerumine, sest väli orienteerib väga väikese osa elektrone. Antud osa elektrone on proportsionaalne väljatugevusega ning see seletab lineaarset sõltuvust. Ferromagnetilise materjali tõmbejõud on palju suurem ja mittelineaarne, see nähtus on ka kergesti vaadeldav, näiteks külmkapimagneti ja külmkapi rauast korpuse vaheline jõud.
Seos elektroni spinniga[muuda | muuda lähteteksti]
Paramagnetilises materjalis on üksikul aatomil või molekulil püsiv magnetiline dipool, see säilib ka välise magnetvälja puudumisel. Püsivat momenti põhjustab paardumata elektroni spinn aatom- või molekulaarorbitaalil. Ilma välise magnetvälja mõjuta paramagnetilises aines dipoolide vahel interaktsioonid puuduvad ja dipoolid on tänu soojusliikumisele korrapäratult orienteeritud. Tänu sellele materjalis magnetmoment puudub. Materjali asetamisel magnetvälja dipoolid orienteeruvad väljas nii, et magnetmoment on välise väljaga samasuunaline. Klassikalise tõlgenduse järgi orienteerumine toimub tänu väändemomendile, mida põhjustab välja magnetmoment, mis proovib dipoole paigutada välja endaga paralleelselt. Tegelikult saab antud nähtust kirjeldada spinni ja impulssmomendi kvantmehaaniliste omadustega.
Kui kahe naaberdipooli vahel on piisav energiavahetus siis nad interakteeruvad ning võivad iseeneslikult joonduda või risti pöörduda. Võivad tekkida magnetilised domeenid, mis põhjustavad ferromagnetismi (püsimagnet) või antiferromagnetismi. Paramagnetilist käitumist võib näha ka ferromagnetilistel materjalidel Curie punktist ning antiferromagnetitel Néeli punktist kõrgematel temperatuuridel. Nendel temperatuuridel ületab vaba soojusenergia spinnidevahelise interaktsiooni energia.
Üldiselt on paramagnetilised efektid üsna väikesed. Magnetiline vastuvõtlikkus on 10−3 ja 10−5 suurusjärkude vahel enamiku paramagneetikute korral, kuid sünteetilistel paramagneetikutel võib väärtus olla väga kõrge, näiteks 10−1 ferrovedelike korral.
Delokalisatsioon[muuda | muuda lähteteksti]
| Nimetus | Magnetiline vastuvõtlikkus (×10−5) |
|---|---|
| Volfram | 6,8 |
| Tseesium | 5,1 |
| Alumiinium | 2,2 |
| Liitium | 1,4 |
| Magneesium | 1,2 |
| Naatrium | 0,72 |
Paljudes metallilistes materjalides on elektronid liikuvad, mis tähendab, et nad saavad liikuda vabalt üle kogu tahkise elektrongaasina. Selline käitumine põhjustab tugevaid interaktsioone naaberaatomite lainefunktsioonide vahel laiendatud võrestruktuuris. Selle tõttu valentselektronide lainefunktsioonid moodustavad keemilise sideme, millel on võrdne arv üles- ja allapoole spinnidega elektrone. Välise magnetvälja rakendamisel ainult fermi nivoole lähedase energiaga elektronid orienteeruvad välja järgi, neid on suhteliselt väikene hulk. Selline nähtus on nõrk paramagnetism, mida nimetatakse Pauli-paramagnetismiks. Antud efekt konkureerib alati aatomite vastupidiste spinnidega elektronide diamagnetilise mõjuga. Tavaliselt põhjustavad tugevat magnetismi lokaliseerunud elektronid, mitte elektrongaasina liikuvad elektronid. Mõningatel juhtudel võib sideme struktuur moodustuda kahest delokaliseerunud alamsidemest, mis on erinevate spinnide ja energiatega. Kui üks alamside täitub elektronidega eelistatult teisele siis võivad ferromagnetilised omadused ilmneda vabalt liikuvate elektronide tõttu. Selline nähtus leiab tavaliselt aset suhteliselt kitsaste d-sidemete korral, millel on vilets delokalisatsioon.
s ja p elektronid[muuda | muuda lähteteksti]
Tugev delokalisatsioon tahkises tänu naaberlainefunktsioonide kattuvusele põhjustab elektronide paardumist. Selle tõttu on s- ja p-tüüpi metallid tavaliselt Pauli-paramagneetikud või isegi diamagneetikud (nt kuld). Viimasel juhul sisemiste aatomorbitaalide elektronide diamagnetiline mõju on tugevam kui välimiste orbitaalide peaaegu vabalt liikuvate elektronide paramagnetiline mõju.
d ja f elektronid[muuda | muuda lähteteksti]
Tüüpiliselt ainult d- ja f-elektronide korral võib märgata tugevamaid magnetilisi efekte, eriti kui viimased on tugevalt lokaliseerunud. Lisaks lantanoidide magnetmoment võib olla üsna suur, sest need saavad omada kuni 7 paardumata elektroni, näiteks gadoliinium(III) kasutatakse seetõttu MRT-s. Lantanoidide suure magnetmomendi tõttu kasutatakse neid supertugevates magnetites, viimaste põhielemendiks on tüüpiliselt neodüüm või samaarium.
Molekulaarne lokalisatsioon[muuda | muuda lähteteksti]
Ülevalpool toodud kirjeldus on üldistatud ning tegelikult kirjeldab rohkem laiendatud võrestruktuuri kui molekulaarset struktuuri. Molekulaarses struktuuris võivad samuti elektronid lokaliseeruda. Kuigi energeetilistel põhjustel ei saa molekulis olla osaliselt täidetud molekulaarorbitaale (st paardumata elektrone), siiski looduses eksisteerivad mõned nn. täitmata orbitaalidega struktuuriüksused. Heaks näiteks on molekulaarne hapnik. Isegi külmutatud tahkises eksisteerivad siiski di-radikaalsed molekulid, mis põhjustavad paramagnetilist käitumist. Paardumata spinnid asuvad orbitaalidel, mis tulenevad hapniku p lainefunktsioonist, O2 molekulis on kattumine piiratud naaberaatomi poolt. Võres on hapniku molekulide vaheline kaugus liiga suur delokaliseerumiseks ning seetõttu jäävad magnetmomendid paardumata.
Curie seadus[muuda | muuda lähteteksti]
Paramageetikute magneetumuse (magnetiseerituse astme) sõltuvust temperatuurist kirjeldab lähedaselt Curie seadus. Seadus väidab, et paramagnetiliste materjalide magnetiline vastuvõtlikkus on pöördvõrdelises seoses temperatuuriga:
kus
- on magneetumus
- on magnetiline vastuvõtlikkus
- on välise magnetvälja tugevus, ühik amper meetri kohta
- on absoluutne temperatuur, ühik kelvin
- on igale materjalile eriomane Curie konstant
Curie seadus kehtib tavaliselt kasutatavatel madala magnetiseerituse (μBH ≲ kBT) tingimustel, kuid ei kehti tugeva välja/madala temperatuuri tingimustes, mille korral esineb magnetiline küllastus (μBH ≳ kBT) ning kõik magnetilised dipoolid on joondunud välise välja järgi. Kui kõik dipoolid on joondunud, siis välise välja tugevnemine ei tugevda summaarset magneetumust, sest edasine joondumine ei ole võimalik.
Paramagnetiliste ioonide korral, mille nurkmoment on ning magnetmomentide vahel interaktsioon puudub, on Curie konstant seotud üksiku iooni magnetmomendiga:
- kus .
Nendes valemites
- on Avogadro arv
- on Boltzmanni konstant
- on efektiivne magnetmoment paramagnetilise iooni kohta
- on Bohri magnetron
- on Landé g-faktor
Kui kasutada klassikalist lähenemist, mille korral molekulaarseid magnetmomente käsitletakse diskreetsete suurustena μ, siis Curie seadus avaldub samal kujul, ainult μeff asemele tuleb kirjutada μ.
Kui orbitaalse nurkmomendi panus magnetmomenti on väike, siis efektiivne magnetmoment avaldub kujul
kus n on paardumata elektronide arv. Võrrand kehtib enamiku orgaaniliste radikaalide ja oktaeedriliste üleminekumetallide komplekside puhul (milles on d3 või kõrgespinniline d5 konfiguratsioon).
Paramagneetikute näited[muuda | muuda lähteteksti]
Paramagnetiliste materjalide all peetakse üldjuhul silmas neid, mis arvestatavas temperatuurivahemikus omavad Curie seaduse või Curie-Weissi seadusele vastavat magnetilist vastuvõtlikkust. Iga aatomit, molekuli või iooni, millel on paardumata elektron, võib nimetada paramagnetiks, kuid nendevahelisi interaktsioone peab põhjalikult uurima.
| Molekulvalem | μeff/μB |
|---|---|
| [Cr(NH3)6]Br3 | 3,77 |
| K3[Cr(CN)6] | 3,87 |
| K3[MoCl6] | 3,79 |
| K4[V(CN)6] | 3,78 |
| [Mn(NH3)6]Cl2 | 5,92 |
| (NH4)2[Mn(SO4)2]•6H2O | 5,92 |
| NH4[Fe(SO4)2]•12H2O | 5,89 |
Minimaalsete interaktsioonidega süsteemid[muuda | muuda lähteteksti]
Lühima definitsiooni kohaselt on tegu paardumata spinnidega süsteemiga, milles spinnid omavahel ei interakteeru. Kitsaimas lähenduses on ainuke paramagnet üheaatomilise vesiniku gaas madalal rõhul, igal aatomil on ainult üks paardumata ja mitteinterakteeruv elektron. Seda võiks ka öelda liitiumigaasi molekulide kohta, kuid liitiumi aatomil on lisaks 2 paardunud elektroni, millest üks põhjustab vastasmärgilist dimagnetilist mõju. Seega on liitium rangelt võttes segasüsteem, kuigi dimagnetiline komponent on väga nõrk ning jäetakse tihti arvestamata. Raskemate elementide korral muutub dimagnetilise komponendi mõju määravamaks ja näiteks metallilise kulla korral domineeribki dimagnetiline komponent. Tegelikult ei kutsuta vesiniku aatomit peaaegu mitte kunagi paramagnetiks, sest selle üheaatomiline gaas on stabiilne ainult ekstreemselt kõrgel temperatuuril. Tavatingimustes H aatomid moodustavad H2 molekuli, spinnid paarduvad ja magnetmoment kaob. Seetõttu on vesinik dimagnetiline ning samuti on seda ka enamik teisi elemente. Kuigi enamiku aatomite ja ioonide elektronkonfiguratsioonis on paardumata spinnid, ei ole õige kutsuda neid paramagneetikuteks, sest standardtemperatuuril spinnid paarduvad. Paardumistendents on nõrgim f-elektronidele, sest f-orbitaalid (eriti 4f) on radiaalselt koondatud ja kõrvalaatomite orbitaalidega kattumine on väike. Tänu sellele on täielikult täitumata 4f-orbitaalidega lantanoidid paramagnetilised.[4]
Seetõttu on kondenseeritud faasis paramagnetid võimalikud ainult siis, kui spinnide interaktsioonid (põhjustavad paardumist või joondumist) on ära hoitud magnetiliste tsentrite struktuurilise isolatsiooniga. On kaks klassi materjale, mille korral see kehtib:
- Molekulaarsed paramagnetiliste (isoleeritud) tsentritega materjalid.
- Heaks näiteks on d- või f-metallide koordineeritud kompleksid või selliste tsentritega valgud (nt müoglobiin). Sellistes materjalides orgaaniline molekuli osa käitub kui kate, mis kaitseb naaberaatomite spinnide eest.
- Väikesed molekulid võivad olla stabiilsed radikaalidena, näiteks hapnik O2. Sellised süsteemid on väga haruldased, kuna üldjuhul on need väga reaktiivsed.
- Lahjendatud süsteemid.
- Paramagnetiliste osakeste väikese kontsentratsiooni viimine diamagnetilisse võresse, näiteks Nd3+ viimine kaltsiumkloriidi. Antud süsteemis on neodüümi ioonide vahekaugus piisavalt suur, et nad üksteisega ei interakteeruks. Sellised süsteemid on väga tähtsad tundlike uurimismeetodite puhul paramagnetiliste süsteemide uurimisel, elektronide paramagnetiline resonants (EPR).
Interaktsioonidega süsteemid[muuda | muuda lähteteksti]
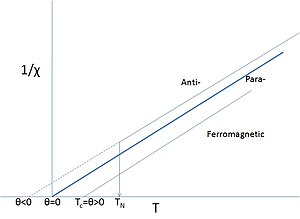
Nagu eespool mainitud, säilitavad paljud d- ja f-elemendid paardumata spinnid. Selliste elementide sooladele on tihtipeale omane paramagnetiline käitumine, kuid piisavalt madalal temperatuuril võivad magnetmomendid korrastuda. Ülevalpool Curie või Curie-Neeli punkti võib nimetada selliseid materjale paramagneetikuteks, eriti olukorras, kus vastavad temperatuurid on väga madalad või neid pole täpselt mõõdetud. Isegi raua kohta saab öelda, et ta muutub ülevalpool oma suhteliselt kõrget Curie-punkti paramagnetiks. Sel juhul saab Curie punkti vaadelda faasimuutusena ferromagneti ja paramagneti vahel. Sõna "paramagnet" viitab nüüd süsteemi lineaarsele sõltuvusele välisest väljast, mille temperatuurisõltuvust saab kirjeldada täiendatud Curie seadusega, mida tuntakse kui Curie-Weissi seadust:
Selles täiendatud seaduses on termin θ, mis kirjeldab vahetusreaktsiooni, mis on tarvis ületada soojusliikumisel. θ märk oleneb sellest, kas domineerivad ferro- või antiferromagnetilised interaktsioonid, ja on väga harva 0.
Curie-Weissi seadusele vastav paramagnetiline kirjeldus ülevalpool TC ja TN on erinev paramagnet-ist, sest see ei tähenda interaktsioonide puudumist vaid seda, et magnetstruktuur on välise välja puudumisel ja kõrgetel temperatuuridel suvalises paigutuses. Isegi θ väärtuse 0 juures ei ole tegu interaktsioonide puudumisega, vaid joonduvad ferromagneetikud ja antijoonduvad antiferromagneetikud tühistavad teineteist. Probleem on lisaks see, et interaktsioonid kristallvõres erinevad erinevates suundades (anisotroopia). Selle tulemusena on korrastunud seisundis magnetstruktuurid väga keerulised.
Suvaline paigutus magnetstruktuuris kehtib ka paljude metallide puhul, nende korral on märgata paramagnetilist võrku laias temperatuurivahemikus. Kuigi neil puudub Curie tüüpi seadusele vastav temperatuurisõltuvuse funktsioon on nende magnetiline vastuvõtlikkus temperatuurist sõltuv. Selline käitumine viitab vabale liikuvusele ning seda on parem kutsuda Pauli-paramagnetismiks, kuigi on ebatavaline näiteks alumiiniumi paramagnetiks nimetada. Seda isegi juhul, kui interaktsioonid on piisavalt tugevad, et elemendil oleks hea elektrijuhtivus.
Superparamagnetid[muuda | muuda lähteteksti]
Mõningatel materjalidel on indutseeritud magnetiline käitumine, mis vastab Curie seadusele, kuid Curie konstantidel on erandlikult suured väärtused. Selliseid materjale tuntakse supermagnetitena. Neid iseloomustatakse kui tugevaid ferromagnetilist või ferrimagnetilist tüüpi ühendeid, milles olevad piiratud suurusega domeenid käituvad üksteisest erinevalt. Sellise süsteemi omadused meenutavad paramagnetit, kuid mikroskoopilisel tasandil on süsteem korrapärane. Antud materjalidele on iseloomulik korrastumistemperatuur, millest ülevalpool käitumine muutub tavalise paramagneti omaks. Heaks näiteks on ferrovedelikud, aga nähtust võib täheldada ka tahkistes. Viimaste korral on paramagnetilised tsentrid viidud hajutatuna hea liikuvusega ferromagnetilisse ühendisse, näiteks kui raud on asendatud ainesse TlCu2Se2 või sulam FeAu. Sellised süsteemid sisaldavad ferromagnetilise ühendi klastreid, mille ferromagnetism lülitub madalal temperatuuril välja. Neid kutsutakse ka miktomagnetiteks.
Vaata ka[muuda | muuda lähteteksti]
Viited[muuda | muuda lähteteksti]
- ↑ G. L. Miessler and D. A. Tarr "Inorganic Chemistry" 3rd Ed, Pearson/Prentice Hall publisher, ISBN 0-13-035471-6.
- ↑ Nave, Carl L. "Magnetic Properties of Solids". HyperPhysics. Vaadatud 9.11.2008.
- ↑ A. F. Orchard, Magnetochemistry, (Oxford University Press: 2003).
- ↑ J. Jensen and A. R. MacKintosh, "Rare Earth Magnetism". Originaali arhiivikoopia seisuga 12.12.2010. Vaadatud 12.07.2009., (Clarendon Press, Oxford: 1991).
Kirjandus[muuda | muuda lähteteksti]
- Charles Kittel, Introduction to Solid State Physics (Wiley: New York, 1996).
- Neil W. Ashcroft and N. David Mermin, Solid State Physics (Harcourt: Orlando, 1976).
- John David Jackson, Classical Electrodynamics (Wiley: New York, 1999).
















