SiRNA
See artikkel ootab keeletoimetamist. (Detsember 2017) |
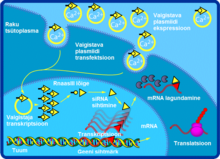
Väike interfereeriv ehk sekkuv RNA (siRNA), mida tuntakse ka nimetustega lühike interfereeruv RNA ja vaigistav RNA, on kaheahelaline RNA molekul, mille pikkuseks on 20–25 aluspaari. siRNA-l on mitmeid rolle, kuid peamiselt osaleb ta RNA interferentsi (RNAi) rajas, kus ta sekkub kindla nukleotiidse järjestusega geenide ekspressiooni. siRNA põhjustab mRNA lagundamise pärast transkriptsiooni, mille tulemusel ei toimu translatsiooni.[1] Lisaks on siRNA kasutuses RNA interferentsiga seotud radades, näiteks käitub siRNA viirusevastastes mehhanismides või genoomis kromatiini struktuuri kujundades. Alles praegu on alustatud eelmainitud radade uurimist.
siRNA-de roll post-transkriptsioonilisel geenivaigistamisel taimedes avastati esmalt David Baulcombesi uurimisgrupis Sainsbury laboris Norwichis Inglismaal ning avaldati esmakordselt ajakirjas Science aastal 1999.[2] Peatselt teatas Thomas Tuschl koos kolleegidega ajakirjas Nature, et sünteetilist siRNA-d saab kasutada ka imetajate rakkudes RNA interferentsi rajal.[3] Selle avastuse tulemusena suurenes huvi kasutada siRNA-d ravimite arendamises ja biomeditsiinilistes uuringutes.
Struktuur
[muuda | muuda lähteteksti]siRNA-del on hästi defineeritud struktuur: see on lühike (enamasti 20–24 aluspaari), kaheahelaline RNA (dsRNA), millel on 5’ ots fosforüleeritud ning 3’ ots hüdroksüleeritud kahe üleliigse nukleotiidiga. siRNA-d toodetakse pikast kaheahelalisest RNA-st ja väikesest juuksenõela RNA-st ja seda protsessi katalüüsib Diceri ensüüm.[4] siRNA-d saab rakkudesse ka transfekteerida. Teoreetiliselt on võimalik vaigistada kõiki geene sünteetilise siRNA-ga, millel on komplementaarne järjestus. Seetõttu on siRNA-d olulised geeni funktsionaalsuse määramisel ja ravimi spetsiifilisusel transkriptsiooni järgsel ajal.
RNAi induktsioon kasutades siRNA-sid või nende biosünteetilisi prekursoreid
[muuda | muuda lähteteksti]
Geenide vaigistamine kasutades genoomivälist siRNA-d, mis on viidud rakkudesse transfekteerides, ei ole väga efektiivne, sest siRNA pakutud efekt on lühiaegne, eriti kui tegemist on kiiresti jagunevate rakkudega. Seda saab vältida, kui luua siRNA jaoks ekspressiooni vektor. siRNA järjestust muudetakse nii, et luuakse kaheahelaline rõngas. Tulemuseks on lühike juuksenõela RNA (shRNA), mida Dicer ensüüm on võimeline töötlema uuesti funktsionaalseks siRNA-ks. Tavaliselt kasutatakse RNA polümeraas III promootorit (näiteks U6, mis on seotud geeni splaissimisega või H1, mis on Rnaasi komponent) transkriptsiooni kassetis, mis on mõeldud väikeste tuuma RNA-de (snRNA) transkriptsioonideks. Arvatakse, et snRNA-dest on samuti Diceri ensüüm võimeline tootma funktsionaalseid siRNA-sid.
Geeni vaigistamise efektiivsust saab suurendada ka Cell Squeeze'i (raku pigistamise) tehnikaga, mis on vektorivaba platvorm rakusiseseks transpordiks. Selle käigus muudetakse rakkude kuju mehaaniliselt, viies neid läbi takistuse, mille diameeter on väiksem kui raku diameeter. Mehaanilise töötluse tulemusel tekivad kanalid, mille kaudu on siRNA-l võimalik rakku siseneda.[5]
siRNA aktiivsus RNAi rajas sõltub suuresti sellest, kuidas on võimeline seonduma RNA-indutseeritud geenivaigistamiskompleks (RISC). Kui siRNA on seondunud RISC-ga, toimub siRNA lahti keerdumine ja senss- ehk kodeeriva ahela hävitamine endonukleaasidega. Allesjäänud antisess- ehk matriitsahela – RISC kompleks seondub sihtmärk mRNA-ga ning algab transkriptsiooniline vaigistamine.[6]
RNA aktivatsioon
[muuda | muuda lähteteksti]Hiljuti avastati, et kaheahealine RNA võib lisaks geeni vaigistamisele ka geene aktiveerida. Seda mehhanismi kutsutakse "väikeseks RNA-indutseeritud geeni aktiveerimiseks" ehk RNAa-ks. On näidatud, et dsRNA sihtmärk geeni promootorid indutseerivad tugevat transkriptsiooni aktiveerimisega seotud geenidel. RNAa töötamist on näidatud inimese rakkudes, kasutades sünteetilist dsRNA-d ning seda nimetati "väikeseks aktiveerivaks RNA-ks (saRNA). Veel ei ole teada, kas RNAa toimib ka teistes organismides.[7]
Väljakutse: ebaspetsiifiliste efektide vältimine
[muuda | muuda lähteteksti]Kuna RNAi sekkub ka mitmetesse teistesse signaali radadesse, võib juhtuda, et siRNA võib vahel põhjustada ebaspetsiifilisi efekte. Imetaja rakk võib kaheahelalist RNA-d, nagu on siRNA, pidada viiruse kõrvalproduktiks ning lasta immuunsüsteemil see hävitada. Veel enam, kuna mikroRNA sarnaneb struktuurilt siRNA-ga ning mikroRNA reguleerib geeni ekspressiooni suuresti tänu ebatäielikule komplementaarsusele aluspaaride vahel sihtmärk mRNA-ga, siis võib siRNA rakku viimine põhjustada vale geeni vaigistamise.
Kaasasündinud immuunsus
[muuda | muuda lähteteksti]Kui viia korraga liiga palju siRNA-d rakkudesse, võib juhtuda, et aktiveerub kaasasündinud immuunsus ning juhtub mitmeid ebaspetsiifilisi sündmusi.[8] Viimaste uurimuste järgi arvatakse, et selle põhjuseks on kaheahelalise RNA sensor PKR, kuid põhjuseks võib olla ka retinoidhappega indutseeritav geen I (RIG-I). Protsessis on kirjeldatud ka tsütokiini aktiveerimist Toll-sarnase retseptor seitsme (TLR7) vahendusel. Üheks lahenduseks ebaspetsiifiliste efektide vähendamiseks on muuta siRNA mikroRNA-ks. MikroRNA-sid leidub organismis loomulikult ning kasutades nende endogeenseid radu, peaks olema võimalik saavutada samasugune geeni vaigistamise efekt oluliselt madalama kontsentratsiooni juures võrreldes siRNA-ga. Kasutades mikroRNA-d peaks vähenema ebaspetsiifiliste efektide arv.
Möödasihtimine
[muuda | muuda lähteteksti]siRNA kasutamisel geeni vaigistamiseks on mureks mööda sihtimine. Sellisel juhul geenid, mis ei ole täielikult komplementaarsed, võidakse kogemata vaigistada siRNA abil (sest siRNA käitub kui miRNA) ning see võib viia andmete valele tõlgendamisele ja potentsiaalsele toksilisusele. Seda probleemi saab osaliselt vähendada, korraldades sobilikke kontrolleksperimente ning samuti arendatakse jõudsalt siRNA algoritme, mis oleksid vabad mööda sihtimisest. Kasutades kogu genoomi ekspressiooni uuringuid, näiteks mikrokiipide abil, on võimalik kontrollida uute siRNA-de töötamist ning arendada algoritme veelgi. 2006. aastal avaldatud uurimus Dr. Khvorova laborist näitas, et siRNA-des 6–7 aluspaari pikkused jupid alates teisest positsioonist kattuvad valesti vaigistatud geenide 3’UTR regioonidega.[9]
Terapeutiline rakendamine
[muuda | muuda lähteteksti]Teoorias on võimalik vaigistada igat geeni RNAi raja kaudu, kasutades siRNA-sid. Seetõttu on siRNA-de vastu suur huvi nii elementaar- kui ka rakendusbioloogias.[10] Järjest enam jälgitakse suuremõõtmelisi RNAi radu, et teha kindlaks, millised on olulised geenid erinevates bioloogilistes protsessides. Eeldatakse, et kuna haigused sõltuvad tihti mitmest geenist, siis ühe geeni vaigistamist siRNA-ga võiks kasutada teraapiana.
Samas, kui rakendada RNAi siRNA-de vahendusel elavates organismides, eriti inimestes, tekivad mitmed takistused. Katsed on näidanud, et siRNA efektiivsus sõltub raku tüübist, kuid põhjust veel ei mõisteta. Mõned rakutüübid vastavad siRNA-le hästi ning toimub geeni vaigistamine, samas teistes rakutüüpides puudub geeni vaigistamine täielikult (kuigi on toimunud tõhus transfektsioon).
I faasi tulemused aastal 2005 kahele esimesele RNAi katsetele (mis olid vananemisega seotud kollatähni degeneratsiooni ehk AMD vastu) näitasid, et siRNA-d on hea kasutada ning sellel on farmakokineetilised omadused.[11]
Teise eksperimendi esimese faasi kliinilistel katsetel oli 41 patsienti, kellel olid vähi metastaasid jõudud maksa. Neile manustati RNAi-d lipiidsete nanopartiklite vahendusel. RNAi sihtmärgiks olid kaks geeni, mis kodeerivad vähi rakkude kasvamiseks vajalikke valke. Need valgud on vaskulaarse endoteeli kasvufaktor (VEGF) ja kääviniidi kinesiini valk (KSP). Tulemused olid kliinilisest vaatepunktist kasulikud, vähk stabiliseerus pärast kuut kuud või mõne patsiendi puhul vähenesid metastaasid. Farmakodünaamilised biopsia analüüsid näitasid, et patsientidelt võetud kudedes olid RNAi kompleksid. See tõestas, et molekulid jõudsid ettenähtud sihtmärk-rakkudesse.[12]
Kontseptsiooni uuringud on näidanud, et Ebola viirusele suunatud siRNA-d võivad olla inimestel efektiivsed kokkupuutejärgsed profülaktikavahendid. Katses elasid kõik osalenud ahvilised üle surmava koguse Zaire Ebola viirust (ZEBOV), mis on kõige ohtlikum ebola tüvi.[13]
Vaata ka
[muuda | muuda lähteteksti]Viited
[muuda | muuda lähteteksti]- ↑ Agrawal N, Dasaradhi P. V. N., Mohmmed A, Malhotra P, Bhatnagar R K, and Mukherjee S K (2003). "RNA Interference: Biology, Mechanism, and Applications". Microbiol Mol Biol Reviews. 67 (4): 657–685. DOI:10.1128/MMBR.67.4.657-685.2003. PMID PMC309050.
{{cite journal}}: kontrolli parameetri|pmid=väärtust (juhend)CS1 hooldus: mitu nime: autorite loend (link) - ↑ Hamilton A, Baulcombe D (1999). "A species of small antisense RNA in posttranscriptional gene silencing in plants". Science. 286 (5441): 950–2. DOI:10.1126/science.286.5441.950. PMID 10542148.
- ↑ Elbashir S, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T (2001). "Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells". Nature. 411 (6836): 494–988. DOI:10.1038/35078107. PMID 11373684.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Bernstein E, Caudy A, Hammond S, Hannon G (2001). "Role for a bidentate ribonuclease in the initiation step of RNA interference". Nature. 409 (6818): 363–6. DOI:10.1038/35053110. PMID 11201747.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Armon Sharei, Janet Zoldan, Andrea Adamo, Woo Young Sim, Nahyun Cho, Emily Jackson, Shirley Mao, Sabine Schneider, Min-Joon Han, Abigail Lytton-Jean, Pamela A. Basto, Siddharth Jhunjhunwala, Jungmin Lee, Daniel A. Heller, Jeon Woong Kang, George C. Hartoularos, Kwang-Soo Kim, Daniel G. Anderson, Robert Langer, and Klavs F. Jensen (2013). "A vector-free microfluidic platform for intracellular delivery". PNAS. DOI:10.1073/pnas.1218705110.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Daneholt, B. (2006). "Advanced Information: RNA interference". The Novel Prize in Physiology or Medicine.
- ↑ Li LC (2008). "Small RNA-Mediated Gene Activation". RNA and the Regulation of Gene Expression: A Hidden Layer of Complexity. Caister Academic Press. isbn=978-1-904455-25-7.
{{cite book}}: puuduv püstkriips kohas:|id=(juhend) - ↑ Whitehead, K. A.; Dahlman, J. E.; Langer, R. S.; Anderson, D. G (2011). "Silencing or Stimulation? SiRNA Delivery and the Immune System". Annual Review of Chemical and Biomolecular Engineering. 2 pages=77-96. DOI:10.1146/annurev-chembioeng-061010-114133. PMID 22432611.
{{cite journal}}: puuduv püstkriips kohas:|volume=(juhend)CS1 hooldus: mitu nime: autorite loend (link) - ↑ Birmingham A, Anderson E, Reynolds A, Ilsley-Tyree D, Leake D, Fedorov Y, Baskerville S, Maksimova E, Robinson K, Karpilow J, Marshall W, Khvorova A (2006). "3' UTR seed matches, but not overall identity, are associated with RNAi off-targets". Nat Methods. 3 (3): 199–204. DOI:10.1038/nmeth854. PMID 16489337.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Alekseev OM, Richardson RT, Alekseev O, O'Rand MG (2009). "Analysis of gene expression profiles in HeLa cells in response to overexpression or siRNA-mediated depletion of NASP". Reproductive Biology and Endocrinology. 7: 45. DOI:10.1186/1477-7827-7-45. PMC 2686705. PMID 19439102.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Kaiser PK, Symons RC, Shah SM, Quinlan EJ, Tabandeh H, Do DV, Reisen G, Lockridge JA, Short B, Guerciolini R, Nguyen QD; (2010). "RNAi-based treatment for neovascular age-related macular degeneration by Sirna-027". Am J Ophthalmol. 150 (1): 33–39. PMID 20609706.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) CS1 hooldus: üleliigsed kirjavahemärgid (link) - ↑ Tabernero J, Shapiro G I, LoRusso P M, Cervantes A, Schwartz G K, Weiss G J, Paz-Ares L, Cho D C, Infante J R, Alsina M, Gounder M M, Falzone R , Harrop J, Seila White A C, Toudjarska I, Bumcrot D, Meyers R E, Hinkle G E, Svrzikapa N, Hutabarat R M, Clausen V A, Cehelsky J, Nochur S V, Gamba-Vitalo C, Vaishnaw A K, Sah D W Y, Gollob J A, Burris III H A (2013). "First-in-Man Trial of an RNA Interference Therapeutic Targeting VEGF and KSP in Cancer Patients with Liver Involvement". Cancer Discovery. DOI:10.1158/2159-8290.CD-12-0429. PMID 23358650.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Prof Thomas W Geisbert PhD, Amy CH Lee MSc, Marjorie Robbins PhD, Joan B Geisbert, Anna N Honko PhD, Vandana Sood MSc, Joshua C Johnson BSc, Susan de Jong PhD, Iran Tavakoli BSc, Adam Judge PhD, Lisa E Hensley PhD, Ian MacLachlan PhD, "Postexposure protection of non-human primates against a lethal Ebola virus challenge with RNA interference: a proof-of-concept study", J Infect Dis. (2006) 193 (12): 1650-1657.
