Pöördfaaskromatograafia
Pöördfaaskromatograafia (ka pööratud faasi vedelikkromatograafia, reversed-phase high performance liquid chromatography- RP-HPLC) on kõrgsurvevedelikkromatograafia alaliik ning enim kasutatud eraldusmeetod ainete lahutamiseks kromatograafiliselt. Umbes 90% kromatograafilistest analüüsidest tehakse tänapäeval pöördfaaskromatograafiaga.[1][2] Pöördfaaskromatograafiat kasutatakse enamasti vedelikukromatograafias, vähem gaasikromatograafias.[3] Ainete segu kantakse läbi liikumatu ehk statsionaarse faasi eluendi vooluga. Pöördfaaskromatograafias on statsionaarne faas mittepolaarne, hüdrofoobne ning liikuv faas ehk mobiilne faas on polaarne. Normaalfaaskromatograafias, mida kasutati enne pöördfaaskromatograafiat, on statsionaarne faas polaarne ja mobiilfaas mittepolaarne.[3][4]
Vajalik proovi kogus on tavaliselt milli- ja nanogrammides.[5] Pöördfaaskromatograafia sobib mittelenduvate termolabiilsete ühendite analüüsiks[6]. Kasutatakse laialdaselt analüütilise keemia harudes, nagu kriminalistika, toidutehnoloogia, biotehnoloogia, ravimitööstus ja meditsiin.[7]
Eraldusmeetodid vedelikkromatograafias[muuda | muuda lähteteksti]
Vedelikkromatograafias kasutatakse nelja põhilist eraldusmeetodit, et eraldada aineid segudest.
- Pöördfaaskromatograafia.
- Normaalfaas- ja adsorptsioonikromatograafia (Statsionaarne faas on polaarsem kui mobiilne faas. Mobiilfaasiks on mittepolaarne orgaaniline solvent A ja polaarne orgaaniline solvent B. Mobiilfaas ei sisalda vett).
- Ioonvahetuskromatograafia (Statsionaarse faasi pinnal on laetud rühmad ning mobiilseks faasiks on vee baasil puhver).
- Suuruseralduskromatograafia (Molekulid saavad tungida täidise pooridesse sõltuvalt suurusest).[1][8]
Statsionaarsed faasid ja kolonnid[muuda | muuda lähteteksti]
Pöördfaaskromatograafias kasutatav statsionaarne faas on mittepolaarne. Enamasti on kolonnide täidismaterjaliks silikageel. On ka polümeerseid aluseid, alumiiniumoksiidist ja tsirkooniumoksiidist aluseid, kuid neid kasutatakse enamasti vaid kindlates rakendustes.[2] Kolonnid on täidetud väikese diameetriga poorsete osakestega. Kõige rohkem kasutatakse osakesi suurusega 5 mikromeetrit, 3,5 mikromeetrit ja 2,6 mikromeetrit. Kolonn täidetakse osakestega suure rõhu all, et nad oleksid kolonni kasutades stabiilsed. Osakeste pinnal on keemiliste sidemetega seotud mittepolaarsed süsivesinikahelad (tavalisemad on C18 või C8 ehk vastavalt 18 või 8 süsinikku reas, aga ka C2), mis eraldavad proovi komponendid üksteisest. Silikageeli baasil valmistatud statsionaarsed faasid annavad suurema efektiivsuse, võrreldes kõigi teiste alusmaterjalidega. Silikageel on mehaaniliselt tugev (jäik), mis tagab stabiilsed omadused. See ei pundu vees ega orgaanilistes solventides ning võimaldab gradientelueerimist. Pind on keemiliselt modifitseeritav ehk muudetav.[4]
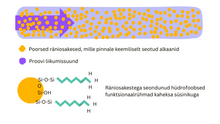
End-capping[muuda | muuda lähteteksti]
Kromatograafias kasutamiseks peab silikageeli pind olema kaetud silanooli kihiga –SiOH. Selleks modifitseeritakse silikageeli pinda mittepolaarsete rühmadega. Suurem osa vabadest silanoolidest jääb siiski reageerimata steerilise takistuse tõttu.[4] Kuna sidumata silanoolid on happelised ja reaktsioonivõimelised proovi aluseliste komponentidega, siis on vaja vabade silanoolide hulka vähendada. Selleks viiakse läbi end-capping ning aluse pinda töödeldakse mõne väiksema silanooliga (nt trimetüülkloorsilaaniga). Kui asendada pikk hüdrofoobne (nt C18) ahel metüülrühmaga, muutub reagent väiksemaks ja pääseb järelejäänud vabadele silanoolidele ligi. Selle järel on kolonn end-capped. Ka pärast seda protseduuri on umbes pooled silanoolidest siiski sidumata. Kui kasutada ainult end-cappingu reagenti (ilma C18 ahelate lisamiseta), siis vastav pind ei oleks väga stabiilne, sest väiksemad rühmad hüdrolüüsuvad madala pH juures kiiresti. Happelistes tingimustes kolonni stabiilsus kasvab seotud faasi pikkuse kasvades. Pikemad ahelad kaitsevad end-capped rühmi hüdrolüüsi eest ja need omakorda vähendavad sidumata pinna reaktiivsust. Seetõttu kasutatakse pöördfaaskromatograafias peamiselt C8 ja C18 ahelaga end-capped kolonne.[4][9]
Mobiilsed faasid[muuda | muuda lähteteksti]
Liikuva ehk mobiilse faasi moodustavad kasutatavad lahused, milles uuritav analüüt läbib kolonni. Polaarsuse vähenemisega lahusti tugevus suureneb. Enimkasutatavad eluendid on vesi (nõrgeim) < metanool < atsetonitriil < etanool < tetrahüdrofuraan < propanool < metüleenkloriid (tugevaim). Kasutatakse lisaks dimetüülsulfoksiidi, dioksaani, propanooli, methoksüetanooli.[5]
Pöördfaaskromatograafias kasutatakse analüütide elueerimiseks vee (solvent A) ja orgaaniliste solventide (B) segu. Solvendid peavad veega segunema. Võimalik on kasutada nii isokraatilist elueerimist kui ka gradientelueerimist. Mobiilfaasi pH mõjutab analüüdi retentsiooniaega ja võib muuta teatud analüütide selektiivsust. Kui mobiilne faas on polaarsem kui statsionaarne faas, siis polaarne analüüt liigub kiiremini ning väljub kolonnist esimesena ja vähem polaarne aine aeglasemalt ning tuleb kolonnist välja hiljem.[4]
RP-HPLCs tuleb erinevate lahuste korral võtta arvesse nende puhtust, stabiilsust, sobivust kolonni ja detektoriga, pidades silmas UV-kiirguse neeldumist ning mõju rõhule. Sagedamini kasutatavad mobiilsed faasid sobivad kokku kasutatavate detektoritega. Tihti kasutatakse gradientelueerimist.[10][5] Kasutatud lahused peavad olema kõrge kvaliteediga ja ülipuhtad.[10] Puhvrite kasutamise eesmärgiks on pH säilitamine ning parema piikide kuju ning lahutatavuse tagamine. Soovituslik on valida puhvrile pH, mis erineb analüüdi dissotsatsioonikonstandist (pKa) kahe pH ühiku võrra. Kasutatakse ammooniumatsetaati, ammooniumfosfaati, sipelghapet, trifluoroäädikhapet jpt.[10]
Liigse vee kasutamisel võib kolonnil, mida pole selle eesmärgiga disainitud, esineda statsionaarse faasi kollaps, mis seisneb alküülahelate täielikus kokkuvoltumises, kuid orgaanilise lahuse mõjul võib algne konformatsioon taastuda.[10]
Isokraatiline elueerimine ja gradientelueerimine pöördfaaskromatograafias[muuda | muuda lähteteksti]
Isokraatiline elueerimine[muuda | muuda lähteteksti]
Mobiilse faasi koostis analüüsi/jooksu käigus ei muutu (näiteks metanool – vesi 50/50). Kasutatakse rohkem lihtsate proovide analüüsimiseks ja kvaliteedikontrolli teostamiseks. Isokraatiline elueerimine võtab vähem aega, sest kolonni ei ole vaja analüüsi järel tasakaalustada. Nõuab lihtsamat aparatuuri.[1]
Gradientelueerimine[muuda | muuda lähteteksti]
Mobiilse faasi koostis muutub analüüsi käigus (näiteks 5 kuni 100% metanool – vesi). Tugevamat elueerivat jõudu omava mobiilfaasi komponendi sisaldus mobiilfaasis kasvab elueerimise käigus. Mobiilse faasi solvent "B" osakaal tõuseb ajas. Kasutatakse rohkem bioloogiliste ning teiste keerukate proovide analüüsimiseks, mis sisaldavad suuri molekule. Kõige rohkem kasutatakse lineaarset gradienti. Gradientelueerimist kasutatakse ka proovide puhul, mis sisaldavad pika retentsiooniajaga segavaid ühendeid ning mis võivad kolonni rikkuda või elueeruda järgmistel kromatograafilistel jooksudel. Kõige tavalisem põhjus, miks valida gradientelueerimine, on analüütide lai retentsioonivahemik. Kui proovi mõni aine elueerub nõrgema mobiilse faasi juures (nt 50% solvent B-d) ja mõni tugevama mobiilse faasi juures (nt 80% solvent B-d), siis on kasulikum teha gradientelueerimist. Gradientelueerimine nõuab keerukamat aparatuuri ja kõik vedelikkromatograafias kasutatavad detektorid ei sobi selle meetodi jaoks.[1][4]
Analüütide lahutamine[muuda | muuda lähteteksti]
Pööratud faasi kromatograafias väljuvad esimesena hüdrofiilsed molekulid, retentsiooniaeg on pikem mittepolaarsetel ehk vähem vesilahustuvatel ainetel.[6][5] [10]Mobiilse faasi madala pH juures on need happelised, kõrge pH juures aluselised ühendid. Retentsioon alanevas järjekorras (alustades kolonnis kauem viibivatest ühenditest): 1) alifaatsed ühendid; 2) indutseeritud dipoolid; 3) püsivad dipoolid; 4) nõrgad ning seejärel tugevad Lewise alused; 5) tugevad Lewise happed (karboksüülhapped) ning nõrgad Lewise happed (alkoholid, fenoolid) [10]. Pöördfaasi kromatograafia ei ole parim valik, kui on vaja lahutada väga hüdrofoobseid ning hüdrofiilseid ühendeid; akiraalseid ja kiraalseid isomeere või biomolekule, milleks saab kasutada normaalfaasi või hüdrofoobsete interaktsioonide kromatograafiat.[5]
Analüütide lahutamisel on olulised erinevad kolonni puudutavad detailid – tüüp, seotud faasi omadused, funktsionaalrühmade kogus ja pindala, mis mõjutavad statsionaarse faasi polaarsust ning seega ka retentsiooniaegu[10][5]. Lisaks eristab erinevaid toodetud kolonne silanoolide aktiivsus, millel on mitu efekti: a) mitteioniseerunud silanoolid (happelises mobiilses faasis) võivad käituda vesiniksideme doonoritena; b) ioniseerunud silanoolid (neutraalses või aluselises mobiilses faasis) omavad katiooni vahetusaktiivsust ning c) võivad mingitel juhtudel käituda vesiniksidemete aktseptorina. Tingituna erinevatest proovimaterjalidest ning detailide olulisusest on meetodi üldist analüütilist võimekust üritatud täiendada ning loodud kolonne, mille statsionaarne faas sisaldab lisaks tsükloheksüül- või fenüülgruppide, või mille funktsionaalrühmade otsad on kaetud (end-capping).[10][10]
Retentsiooniaeg sõltub temperatuurist, analüüdi polaarsusest ja statsionaarse faasi kontaktpinnast. Interaktsioonimehhanismid sisaldavad veel teadmata nüansse ning neid peetakse kompleksseks. Sellegipoolest on neid võimalik ligikaudselt hinnata.[10] [5]
Populaarsus ja kasutus[muuda | muuda lähteteksti]
Pöördfaaskromatograafiat saab rakendada väga paljudele analüütilise keemia harudele ning see sobib paljude ainete eraldamiseks just oma laia molekuli suuruse vahemiku tõttu. Seda kasutatakse nii looduslikult esinevate kui ka keemiliselt sünteesitud peptiidide ja valkude ehk proteiinide analüüsimiseks ja puhastamiseks. Samuti uuritakse sellega peptiide seedimisprotsessi tulemusena ja keemiliselt sünteesitud oligonukleotiidide.[11][12][13] Pöördfaaskromatograafia kolonnid on tõhusad ja stabiilsed ning meetod on üsna robustne ja korratav.[4] Saab kontrollida orgaanilise solvendi tüüpi ja kontsentratsiooni, pH-d ja temperatuuri. Populaarsusele aitab kaasa ka see, et suures osas on eluendiks vesi, mis on odav ja keskkonnasõbralik.[2]
Viited[muuda | muuda lähteteksti]
- ↑ 1,0 1,1 1,2 1,3 Agilent Technologies, HPLC Basics, Fundamentals of Liquid Chromatography (HPLC). Viimati vaadatud 29.09.2014
- ↑ 2,0 2,1 2,2 Henk A. Claessen (1999), Characterization of stationary phases for reversed-phase liquid chromatography, Eindhoven, ISBN 90-386-0658-3
- ↑ 3,0 3,1 IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997).(2006–)"reversed-phase chromatography"
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 L.R. Snyder, J.J. Kirkland, J.L. Glaych, "Practical HPLC Method Development"(1997), 2nd ed., ISBN 978-0-471-00703-6
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5,6 Toshihiko, Hanai (1999). HPLC: A Practical Guide.
- ↑ 6,0 6,1 Skoog, Douglas A.; West, Donald M.; Holler, James; Crouch, Stanley R. (2022). Fundamentals of Analytical Chemistry. Tenth Edition.
- ↑ A.Mehta (2012), Principle of reversed phase chromatography HPLC/UPLC
- ↑ "lamondlab.com, RPLC". Originaali arhiivikoopia seisuga 1. detsember 2014. Vaadatud 4. novembril 2014.
- ↑ J.Dolan, Separation Science,end-capping
- ↑ 10,00 10,01 10,02 10,03 10,04 10,05 10,06 10,07 10,08 10,09 Meyer, Veronica (2010). Liquid Chromatography. Fifth Edition.
- ↑ Amelie E. Karlström, Hydrophobic Interaction Chromatography (HIC),Reversed-Phase Chromatography (RPC). Viimati vaadatud 3.10.2014
- ↑ Grace Vydac(2002), "The Handbook of Analysis and Purification of Peptides and Proteins by Reversed-Phase HPLC", 3rd ed
- ↑ GE Healthcare Life Sciences[alaline kõdulink]
