Faasiülekande katalüüs
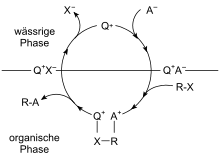
Faasiülekande katalüüs on heterogeense katalüüsi erivorm, mis põhineb teatud katalüsaatorite võimel kanda reagente ühest faasist teise, luues võimaluse reaktsiooni toimumiseks.[1] Põhiliselt tekib vajadus rakendada faasiülekande katalüüsi, kui soovitakse läbi viia reaktsiooni tugevalt polaarse või ioonilise aine ja mittepolaarse aine vahel. Ioonsed ja polaarsed reagendid on stabiilsed vee faasis ning kanduvad vaid vähestes kogustes üle orgaanilisse faasi. Katalüsaatori lisamine võimaldab polaarsel reagendil vabalt liikuda üle faasidevahelise piirpinna, kiirendades oluliselt reaktsiooni.
Rakendades faasiülekande katalüüsi on võimalik saavutada paremat selektiivsust, kõrgemaid saagiseid ja vähem kõrvalprodukte. Lisaks kaob vajadus kasutada kalleid või ohtlikke lahusteid, mis oleks võimelised lahustama vajalikke reagente ühes faasis. Selline lähenemine on eriti tähtis rohelise keemia seisukohast. Kui osa aineid lahustada algselt vees, väheneb vajamineva orgaanilise lahusti maht, mis omakorda tähendab, et ohtlike orgaaniliste jääkide maht väheneb.[2][3]
Faasiülekande katalüüsi rakendamine on võimalik ka vedeliku-tahkise süsteemides.[1]
Olemus[muuda | muuda lähteteksti]
Kahe omavahel segunematu vedela faasiga süsteemis tekib piirpind, mis takistab eri faasides lahustunud ainete omavahelist reaktsiooni. Näiteks 1-klorooktaani ja naatriumtsüaniidi lahused moodustavad kaks kihti. Taolise segu mitme päeva jooksul kuumutamine ja segamine ei anna vastavat asendusreaktsiooni.
Kui aga lisada sobivat kvaternaarset ammoonium- või fosfooniumsoola, toimub asendumine pea täielikult 2–3 tunni jooksul.
- C8H17Br(org) + NaCN(aq) → C8H17CN(org) + NaBr(aq) (katalüüsitud R4P+Cl− poolt)
Lisatud ooniumioon moodustab soola tsüaniidiooniga ning tänu ooniumühendi alküülahelatele on tekkinud sool lahustuv orgaanilises faasis, kus toimub reaktsioon 1-klorooktaaniga.[4]
Toimemehhanismi teooriad[muuda | muuda lähteteksti]
Kuigi faasiülekande katalüüs on laialt kasutatav orgaanilises sünteesis, on selle täpne toimemehhanism veel vaidlusalune teema. Põhiline takistus ühese teooria loomisel on kahefaasilise süsteemi ja piirpinna uurimise keerukus. Tähtsamad teooriad on Starksi ekstraheerimismehhanism, Brändströmi-Montanari modifikatsioon sellest ja Makosza piirpinna mehhanism. Need teooriad on loodud seletama nukleofiilset asendust kahe vedela faasiga süsteemis.
Starksi ekstraheerimismehhanismi järgi on katalüsaatoril nii hüdrofoobsed kui hüdrofiilsed omadused. See on jaotunud mõlema faasi vahel ja võib vabalt nendevahelist piirpinda ületada, kandes endaga kaasas nii reagendi kui produkti aniooni.[5]
Brändströmi-Montanari modifikatsiooni järgi on katalüsaator hüdrofoobne ning esineb vaid orgaanilises faasis või piirpinnal. Reageeriv anioon liigub piirpinnale ning seostub katalüsaatoriga, mis seejärel liigub orgaanilise faasi sisemusse.[6]
Makosza piirpinna mehhanism kirjeldab süsteemi, kus nukleofiilne rühm on alküülahel. Selle alusel moodustub alguses faasidevahelisel piirpinnal metallkarbanioon. Katalüsaatori toimel liigub karbanioon orgaanilisse faasi, kus see reageerib elektrofiiliga. Makosza mehhanism, sarnaselt Brändströmi-Montanari modifikatsiooniga, esineb tõenäolisemalt siis, kui katalüsaator on hüdrofoobne.[7]
Ajalugu[muuda | muuda lähteteksti]
Faasiülekande katalüüsi uurimine sai alguse 1960. aastatel kolmes eraldi uurimisgrupis M. Makosza, C. M. Starksi ja A. Brändströmi poolt. Lühikeste vahedega avaldati mitu artiklit faasiülekande toimumisest kvaternaarsete ammooniumsoolade abil. Makosza uuris kahefaasilises süsteemis enolaatide alküülimist ja tsüklopropaani moodustumist. Ta kirjeldas nähtust kui "katalüütilist kahefaasilist reaktsiooni." Brändström töötas välja mitu alküülimismeetodit, kasutades stöhhiomeetrilistes kogusteskvaternaarseid ammooniumsooli. Termini "faasiülekande katalüüs" võttis 1971. aastal kasutusele Starks, kirjeldamaks 1-kloro- ja 1-bromooktaani nukleofiilset asendust naatriumtsüaniidiga. Peale reaktsiooni enese kirjeldamise pakkus Starks välja ka toimemehhanismi, kus tähtsaim osa oli alküülitud ammooniumsoola kandumine ühest faasist teise.[8]
Pärast Starksi töö avaldamist kasvas kiiresti huvi faasiülekande nähtuste vastu ning 1980. aastate alguseks suurenes aastas seda teemat käsitlevate publikatsioonide arv 400-ni. Selle aja jooksul uuriti põhjalikult erinevaid reaktsioone ja võimalikke katalüsaatoreid. 1984. aastal avaldati indakrinooni enantioselektiivse metüleerimise meetod, milles kasutati kiraalset faasiülekande katalüsaatorit.[9] Asümmeetriline süntees kujunes üheks tähtsamaks faasiülekande katalüüsi rakendusvaldkonnaks.
Katalüsaatorite tüübid[muuda | muuda lähteteksti]
Levinumad faasiülekande katalüsaatorid on ooniumsoolad ja krooneetrid.
Kvaternaarsed ammooniumsoolad[muuda | muuda lähteteksti]

Erinevate alküülasendajatega kvaternaarsed ammooniumsoolad olid esimesed uuritavad faasiülekande katalüsaatorid. Need on lihtsa struktuuriga ja vähereaktiivsed ained. Varieerides valitud alküülahelate pikkust, on võimalik muuta ammooniumiooni lahustuvust eri faasides. Kvaternaarsete ammooniumsoolade alla kuuluvad ka keerukama struktuuriga kiinapuu koorest eraldatud cinchona alkaloididest saadud ühendid ning K. Maruoka poolt välja töötatud spirobinaftüülühendid. Nii cinchona alkaloidid kui spirobinaftüülühendid on kiraalsed, seega on nende abil võimalik läbi viia enantioselektiivseid protsesse.[10]
Kvaternaarsed fosfooniumsoolad[muuda | muuda lähteteksti]
Sarnaselt ammooniumsooladega olid fosfooniumsoolad ühed esimesed kasutuselevõetud faasiülekande katalüsaatorid. Sarnaselt ammooniumsooladega on keerukama struktuuriga fosfooniumühendeid võimalik kasutada enantioselektiivsetes protsessides.
Krooneetrid[muuda | muuda lähteteksti]

Krooneetrid on tsüklilised polüeetrid. Neid kasutatakse tihti leelismetallide katioonide stabiliseerimiseks orgaanilistes lahustites, kuid neid on võimalik kasutada ka tahke ja vedela faasiga süsteemides soola lahustamiseks.[10]
Vähem levinud ühendid[muuda | muuda lähteteksti]
Lisaks eeltoodud ainetele on võimalik ka guanidiinide, hüdrasiinide, vase saleenkomplekside, krüptandide, polüetüleenglükooli ja tsüklodekstriinide kasutamine.[10][11][12]
Kasutusalad[muuda | muuda lähteteksti]
Algselt tegelesid faasiülekande katalüüsi uuringud põhiliselt alküülimiste ja asendusreaktsioonidega, kuid järgnenud aastakümnete jooksul töötati välja meetodid, kuidas kahefaasilistes süsteemides läbi viia terve hulk reaktsioonitüüpe.
Mõned näited reaktsioonitüüpidest, kus on võimalik rakendada faasiülekande katalüüsi:
- redoksreaktsioonid,
- aldoolkondensatsioonid,
- elimineerimisreaktsioonid,
- tsükli moodustumised,
- polümeriseerumisreaktsioonid.
Faasiülekande katalüüs on tähtsal kohal ka metallorgaanilises keemias, nii metallorgaaniliste ühendite sünteesil kui ka reaktsioonide läbiviimisel.[13]
Tööstuslikus keemias on faasiülekande katalüüs laialdaselt kasutusele võetud. Näiteks levinuima polükarbonaatmaterjali valmistamiseks on vaja läbi viia fosgeeni ja bisfenool-A vaheline reaktsioon kahefaasilises süsteemis naatriumhüdroksiidi juuresolekul. Taolisi polükarbonaate kasutatakse CD-de, DVD-de, kaitseprillide ja telefonikorpuste valmistamiseks. Sarnaste põhimõtetega valmistatakse peale polükarbonaatide ka polüestreid, polüeetreid ja polüstüreeni. Lisaks on välja töötatud ka meetodeid, kuidas saadud polümeere eri viisidel modifitseerida, saavutades sobivaid keemilisi ja füüsikalisi omadusi.[14]
Polümeeride keemias on lisaks võimalik ka paljusid radikaalpolümerisatsiooniprotsesse läbi viia kahefaasilises süsteemis kaaliumpersulfaadi abil, kasutades kas krooneetreid või kvaternaarseid ammooniumsooli katalüsaatoritena. Kaaliumpersulfaat toimib orgaanilises faasis parema radikaalprotsesside initsiaatorina kui traditsiooniliselt kasutuses olnud bensoüülperoksiid. Lisaks on leitud, et vinüülpolümeriseerimise puhul on sellist sünteesimeetodit kasutades võimalik ka madalatel temperatuuridel omada täpset kontrolli reaktsioonikiiruse üle.[15]
Viited[muuda | muuda lähteteksti]
- ↑ 1,0 1,1 IUPAC Gold Book phase transfer catalysis
- ↑ J. O. Metzger (1998). "Solvent-Free Organic Syntheses". Angewandte Chemie International Edition. 37 (21): 2975–2978.
- ↑ Mieczyslaw Makosza (2000). "Phase-transfer catalysis. A general green methodology in organic synthesis". Pure Appl. Chem. 72 (7): 1399–1403. DOI:10.1351/pac200072071399.
- ↑ Starks, C.M. (1971). "Phase-transfer catalysis. I. Heterogeneous reactions involving anion transfer by quaternary ammonium and phosphonium salts". J. Am. Chem. Soc. 93 (1): 195–199. DOI:10.1021/ja00730a033.
- ↑ Starks, C.M. (1973). "Phase-transfer catalysis. II. Kinetic details of cyanide displacement on 1-halooctanes". J. Am. Chem. Soc. 95 (11): 3613–17. DOI:10.1021/ja00792a025.
- ↑ Brändström, A. (1977). "Principles of phase-transfer catalysis by quaternary ammonium salts". Adv. Phys. Org. Chem. 15: 267–330. ISSN 0065-3160.
- ↑ Starks, C.M., Halper, M. (1994). Phase-Transfer Catalysis: Fundamentals, Applications, and Industrial Perspectives. Springer Science & Business Media. Lk 93-94. ISBN 978-94-011-0687-0.
{{cite book}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Duncan-Gould, N. W. (2011) An investigation of phase transfer catalysis employing quantitative structure-activity relationships. University of Illinois http://hdl.handle.net/2142/26285
- ↑ Dolling, Ulf H.; Davis, Paul; Grabowski, Edward J. J. (1984). "Efficient catalytic asymmetric alkylations. 1. Enantioselective synthesis of (+)-indacrinone via chiral phase-transfer catalysis". J. Am. Chem. Soc. 106 (2): 446–447. DOI:10.1021/ja00314a045.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ 10,0 10,1 10,2 Mastracchio, A. "Phase-Transfer Catalysis" (PDF). Vaadatud 06.10.2014.
- ↑ Landini, D.; Maia, A.; Montanari, F.; Tundo, P. (1979). "Lipophilic [2.2.2] cryptands as phase-transfer catalysts. Activation and nucleophilicity of anions in aqueous-organic two-phase systems and in organic solvents of low polarity". J. Am. Chem. Soc. 101 (10): 2526–2530. DOI:10.1021/ja00504a004.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Trifonov, A.; Nikiforov, T. (1984). "Cyclodextrins as phase-transfer catalysts in a nucleophilic displacement reaction". J. Mol. Catal. 24 (1): 15–18. ISSN 0304-5102.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Gordon, A. (10. juuni 1981). Advances in Organometallic Chemistry, Volume 19. Academic Press. ISBN 978-0-12-031119-4.
- ↑ H. H. Freedman (1986). "Industrial applications of phase transfer catalysis (PTC): past, present and future". Pure & Appl. Chem. 58 (6): 857–868. DOI:10.1351/pac198658060857.
- ↑ Starks, C.M. (1987). "Phase-transfer catalysis: an overview". ACS Symposium Series. 326 (Phase Transfer Catal.): 1–7. DOI:10.1021/bk-1987-0326.ch001.
