Hüdrasiin
| Üldist | |
|---|---|
| Süstemaatiline nimetus | hüdrasiin |
| Teised nimetused | diamiin, diamiid, lämmastik anhüdriid |
| Joonis |  |
| Joonis |  |
| Hüdrasiin hüdraat |  |
| Keemiline valem | N2H4 |
| Välimus | läbipaistev, värvusetu vedelik |
| Füüsikalised omadused | |
| Molaarmass | 32,0452 g mol−1 |
| Sulamis- temperatuur | 275 °K (2 °C) |
| Keemis- temperatuur | 387 °K (114 °C) |
| Tihedus | 1,021 g cm−3 |
| Viskoossus | 0,876 cP |
| Aluselisus(pKa) | 8,10 |
| Happelisus(pKb) | 5,90 |
| Aururõhk | 1 kP ( 30,7 °C juures) |
| Struktuur | |
| Molekulaarne kuju | kolmnurkne püramiid N juures |
| Dipoolmoment | 1,85 D |
| Termokeemia | |
| Standardne entalpia | 50,63 kJ mol−1 |
| Standardne entroopia | 121,52 J K−1 mol−1 D |
Hüdrasiin (ka diamiin, diamiid, lämmastikanhüdriid) on värvitu, hästi lenduv anorgaaniline aine. Selle molekulvalem on N2H4.[1]
Lahustub hästi vees, metanoolis ja etanoolis, kuid lahustumatu mittepolaarsetes orgaanilistes solventides, nagu näiteks benseenis ja tolueenis. Puhas hüdrasiin on väga toksiline ja ebastabiilne ühend. Hüdrasiine valmistatakse peamiselt ammooniumist, dimetüülamiinist, vesinikperoksiidist või naatriumhüpokloritist.[2] Looduslikult võib hüdrasiini väikestes kogustes leiduda ka mõnes taimes.[3]
Hüdrasiin ja selle derivaadid on leidnud väga laialdast kasutust näiteks rakettides, kosmoselaevades ja kosmoselennukites kütusena, boilerites veele lisatuna aitab see vähendada korrosiooni. Hüdrasiinidest valmistatakse põllumajanduskemikaale, ravimeid, vahtkumme ja plaste.[2]
Molekulaarne struktuur ja omadused[muuda | muuda lähteteksti]
Hüdrasiin koosneb kahest lämmastikuaatomist, mis on omavahel seotud kovalentse sidemega.
Tavatemperatuuril ja -rõhul on hüdrasiin hügroskoopne vedelik, millel on ammoniaagi lõhnaga sarnane lõhn. Külmudes moodustab see valgeid kristalle. Hüdrasiin on tugev redutseerija ja nõrgem alus kui ammoonium.[2]
Puhas hüdrasiin laguneb kuumutades ja UV-kiirguse mõjul ammooniumiks, vesinikuks ja lämmastikuks. See reaktsioon võib olla plahvatusohtlik, eriti kui katalüsaatoritena kasutada teatud metalle või metallioksiide.[4]
Hüdrasiin moodustab veega reageerides hüdrasiinmonohüdraadi, mille keemistemperatuur on 120,5 °C. Aluselistes lahustes hüdrasiin autooksüdeerub ja seal on hüdrasiin metalliioonidega, peamiselt vasega, lihtsasti katalüseeritav. Ühe kõrvalproduktina tekib vesinikperoksiid.[4]
Süntees ja tootmine[muuda | muuda lähteteksti]
Esimese hüdrasiiniühendi avastas 1875. aastal Karl Ficher. Selleks ühendiks oli fenüülhüdrasiin. Enne vaba hüdrasiini avastamist sünteesis Karl Ficher veel 20 hüdrasiiniühendit. Alles 1887. aastal valmistati mitmeastmelise sünteesi kaudu esimest korda hüdrasiin puhtal kujul.[5]
Tänapäeval kasutatakse tööstuslikus tootmises peamiselt kolme sünteesimeetodit.
Raschigi reaktsioon[muuda | muuda lähteteksti]
Avastati 1907. aastal. Reaktsioon toimus vedelas olekus ja sisaldas kolme astet.
NaOH + Cl2 → NaOCl + HCl
NH3 + NaOCl → NH2Cl
NH2Cl + NH3 + NaOH → NH2-NH2*H2O + NaCl
See reaktsioon modifitseeriti Olini-Raschigi reaktsiooniks, et saada vaba hüdrasiin[5]:
NH2Cl + NH3 + NaOH → NH2-NH2+ H2O + NaCl
Raschigi reaktsiooni saab kasutada ka amiinide reaktsiooniks kloroamiinidega, et sünteesida monoasendatud või asümmeetrilisi diasendatud hüdrasiine.[6]
Hoffmanni reaktsioon[muuda | muuda lähteteksti]
See reaktsioon põhineb uurea oksüdatsioonil naatriumhüpokloritiga.
Summaarne reaktsioonivõrrand on:
CO(NH2)2 + NaOCl + 2 NaOH→ NH2-NH2 + NaCl + Na2CO3 + H2O
Seda reaktsiooni ei kasutata tööstuslikult alates 2001. aastast, kuigi leidis varem väga laialdast kasutust, sest Raschigi reaktsiooniga võrreldes oli see hüdrasiini sünteesiks ökonoomsem meetod.[6]
Bayeri-ketasiini reaktsioon[muuda | muuda lähteteksti]
Reaktsioon seisneb klooramiini reageerimises ammooniumiga atsetooni juuresolekul tugevalt aluselises keskkonnas.[6]
Peroksiidireaktsioon[muuda | muuda lähteteksti]
Reaktsiooni avastas PCUK (Produits Chimiques Ugine Kuhlmann), mis on Prantsusmaa keemiatehas. Reaktsiooni nimetatakse ka Aftonia-PCUK tsükliks.
Esmalt töödeldakse atsetooni ammooniumiga, et saada imiin. Imiini oksüdeeritakse vesinikperoksiidiga ja saadakse 3,3-dimetüüloksasiridiin. Järgneb hüdrasooni ammonolüüs, kus osaleb veel üks ekvivalentne atsetoon. Järelejääv asiin hüdrolüüsitakse, et saada hüdrasiin ja regenereerida kaks atsetooni molekuli.[2]
Peroksiidireaktsioonil on võrreldes teiste reaktsioonidega palju eeliseid[6]:
- kõrvalsaadustena ei teki sooli;
- suured saagised;
- väike energiakulu;
- hüdrasiini ei tule vedela eluendiga töödelda.
Suurimad hüdrasiini tootjad USAs on Arch Chemical, Bayer ja Fairmont Chemical. 1988. aasta seisuga toodeti seda läänemaailmas umbes 59 miljonit kilogrammi aastas.[6]
Hüdrasiini kasutus läbi aegade[muuda | muuda lähteteksti]
Algselt oli raketikütus hüdrasiini tähtsaimaks kasutuskohaks. 1964. aastal kasutati USAs 73% hüdrasiine selleks eesmärgiks. Ülejäänud osa kasutati peamiselt vaheühendina põllumajanduskemikaalide sünteesimisel, plastifikaatoritena ja ravimite, nagu näiteks tuberkuloosi ravis kasutatud isoniasiidi ja põletikuvastase ravimi hüdralasiini tootmiseks. Vedelat hüdrasiini kasutati boilerites korrosiooni ennetamiseks. 1977. aastaks kasutati ainult 5% maailma hüdrasiinitoodangust kütuseks, 19% aga boilerites vee töötlemiseks, 32% põllumajanduskemikaalide sünteesiks ning 34% plastifikaatorite sünteesiks. Tänapäeval kasutatakse hüdrasiine peamisel toorainena põllumajanduskemikaalide tootmiseks (40%), plastifikaatoritena (33%), polümerisatsiooni katalüsaatoritena ja ravimite tootmiseks. Samuti kasutatakse seda siiani boilerites. Uuemad kasutusvaldkonnad on fotograafia ja metallitööstus. Vähem kasutatakse hüdrasiini raketi- ja varukütuseks.[7]
Hüdrasiini derivaadid ravimitööstuses[muuda | muuda lähteteksti]
Aromaatsed hüdrasiinid ja nende derivaadid[8]
Hüdrasiinid – antidepressandid feniprasiin, fenelsiin.
Karbotsükliliste hapete derivaadid[8]
Hüdrasiidid – angiini ja tuberkuloosi ravimid, antidepressandid (nialaamiid, isokarboksasiid, privasiid).
Semikarbasiidid – palavikku alandavad ravimid, antidepressandid.
Aldehüüdide ja ketoonide derivaadid[8]
Hüdrasoonid – tuberkuloosivastased, antibakteriaalsed ravimid.
Semikarbasoonid – tuberkuloosivastased, antibakteriaalsed, vere hüübimist soodustavad ravimid.
Tiosemikarbasoonid – tuberkuloosivastased, antibakteriaalsed, vere hüübimist soodustavad ravimid.
Tsüklilised hüdrasiini derivaadid[8]
Pürasoolid – antibakteriaalsed, põletikuvastased (MF 389), vere hüübimist soodustavad ravimid.
Pürasoloonid – antibakteriaalsed, serotoniini inhibeerivad, põletikuvastased ravimid (amidopüriin, piperüloon, bensipiperüloon).
Pürasolidiindioonid – põletikuvastased ravimid (fenüülbutasioon).
Tiadiasoolid – antibakteriaalsed, diabeediravimid (glübutiasool).
Püridasiinid – antibakteriaalsed ravimid.
Ftalasiinid – madala vererõhu ravimid (hüdralasiin).
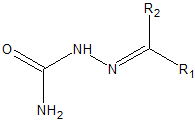
(R1, R2, R3 ja R4 molekulivalemis tähistavad asendusrühmi.)
Toksilisus[muuda | muuda lähteteksti]
Hüdrasiin on väga toksiline aine. Hüdrasiini ühenditega töötades tuleb järgida ettevaatusabinõusid ja kasutada vajalikku kaitsevarustust.
Hüdrasiin on väga lenduv ja selle sissehingamisel võib tekkida kipitustunne hingamisteedes, köha, peavalu, nohu, neeluhaavandid ja värinad. Kui viibida hüdrasiiniaurude käes kaua ja on tunda eelnimetatud sümptomeid, siis tuleb minna värske õhu kätte. Soovitatav oleks pöörduda arsti poole.[1]
Nahale sattumisel on hüdrasiin söövitav ja võib naha kaudu kehasse imenduda. Nahal tekib punetus, põletus ja valu. Nahka tuleks kohe pärast ainega kokkupuutumist loputada rohke veega, seejärel eemaldada saastunud riided ning loputada uuesti. Tuleb pöörduda arsti poole.[1]
Aine on söövitav ka silma sattudes. Tekib punetus ja tugev valu ning sügavad põletused. Silma sattumise korral tuleb silmi viivitamatult loputada mitme minuti jooksul rohke veega ning seejärel pöörduda arsti poole.[1]
Allaneelamise tagajärjel võivad esineda kõhuspasmid, krambid, teadvuse kadu, oksendamine ja nõrkus. Allaneelamise korral loputada suud, kuid oksendamist ei tohi esile kutsuda. Tuleb kiiremas korras pöörduda arsti poole.[1]
Keskkonnamõjud[muuda | muuda lähteteksti]
Hüdrasiin ja selle ühendid võivad loodusesse sattuda tööstusest. Üks peamisi saasteallikaid on raketikütuste põletamine. Ka tööõnnetused ja lekked võivad olla hüdrasiini keskkonda sattumise põhjuseks. Suurema osa lendunud hüdrasiinist seovad ja lagundavad kiiresti õhus leiduvad osakesed. Hüdrasiinid kaovad õhust mõne minuti kuni tunniga.[3]
Vähemal määral satub hüdrasiini otse vette ja mullale. Läbi mulla võib see jõuda ka põhjavette. Vees ja mullas olevad mikroorganismid lagundavad enamiku hüdrasiinist mõne nädalaga. Hüdrasiin võib kalades akumuleeruda. Loomade keha läbib see aine piisavalt kiiresti, et välistada aine kuhjumine.[3]
Tuvastamine[muuda | muuda lähteteksti]
Hüdrasiini on võimalik tuvastada gaasikromatograafiaga (GC) ja kõrgsurve-vedelikkromatograafiaga (HPLC). HPLC korral on vaja elektrokeemilist detektorit (ED). Gaasikromatograafia korral peab detektoriks olema leekionisatsioonidetektor (FID) või lämmastiku-fosfori detektor (NPD). Kui on vaja eriti täpseid tulemusi, siis on võimalik GC-ga ühendada massispektromeeter (MS).[3]
Bioloogilistest materjalidest määramiseks on vaja hüdrasiin proovimaatriksist eraldada ning siduda derivaatideks. Eraldamiseks tuleb esmalt valgujäägid happega sadestada ja pärast lipiidid metüleenkloriidiga ekstraheerida. Hüdrasiini võib derivatiseerida aldehüüdiga, nagu näiteks pentafluorobensaldehüüdiga või p-dimetüülaminobensaldehüüdiga.[3]
Orgaanilistest proovidest (nagu näiteks õhk, vesi, muld, toit ja tubakas) määramise korral eraldatakse hüdrasiin vajaduse korral happe juuresolekul. Tavaliselt kogutakse proov õhust happega või happega kaetud silikageeliga.[3]
Hüdrasiinide sisaldust proovis on raske täpselt määrata, kuna hüdrasiiniühendid autooksüdeeruvad kiiresti.[3]
Viited[muuda | muuda lähteteksti]
- ↑ 1,0 1,1 1,2 1,3 1,4 Ohutuskaart IPCS, CEC 1999
- ↑ 2,0 2,1 2,2 2,3 Hydrazine Chemindustry.ru group
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Toxicological profile for hydrazines, online pdf U.S Department of Health and Human Services, 1997
- ↑ 4,0 4,1 Enviromental health criteria 68, hydrazine World Health Organization, Geneva, 1987
- ↑ 5,0 5,1 Hydrazine(Pdf) Robert Matunas, 2004
- ↑ 6,0 6,1 6,2 6,3 6,4 [1] http://www.sciencemadness.org/talk/files.php?pid=223809&aid=16144
- ↑ p-TOLUENESULFONYL HYDRAZIDE chemicalland21
- ↑ 8,0 8,1 8,2 8,3 Recent pharmaceutical reasearch on hydrazine derivatives(pdf) E. Jucker, Pharmaceutical- Chemical laboratories, Sandoz Ltd. Basle, Switzerland