Liitumisreaktsioon: erinevus redaktsioonide vahel
P pisitoimetamine |
PResümee puudub |
||
| 2. rida: | 2. rida: | ||
Liitumisreaktsioonidesse astuvad [[kaksikside|kaksik-]] või [[kolmikside]]t sisaldavad molekulid: [[alkeenid]] (C=C), [[alküünid]] (C≡C), [[karbonüülrühm]]a (C=O), [[imiinid|imiinrühma]] (C=N) jt sisaldavad ühendid. Näiteks [[etüleen]]i [[halogeenimine|broomimine]]: |
Liitumisreaktsioonidesse astuvad [[kaksikside|kaksik-]] või [[kolmikside]]t sisaldavad molekulid: [[alkeenid]] (C=C), [[alküünid]] (C≡C), [[karbonüülrühm]]a (C=O), [[imiinid|imiinrühma]] (C=N) jt sisaldavad ühendid. Näiteks [[etüleen]]i [[halogeenimine|broomimine]]: |
||
::H<sub>2</sub>C=CH<sub>2</sub> |
::H<sub>2</sub>C=CH<sub>2</sub> + Br<sub>2</sub> → BrH<sub>2</sub>C-CH<sub>2</sub>Br |
||
==Mehhanismid== |
==Mehhanismid== |
||
Olenevalt reaktsioonis osalevate ühendite keemilisest olemusest eristatakse nelja põhilist liitumisreaktsiooni [[reaktsioonimehhanism|mehhanismi]]: |
Olenevalt reaktsioonis osalevate ühendite keemilisest olemusest eristatakse nelja põhilist liitumisreaktsiooni [[reaktsioonimehhanism|mehhanismi]]: |
||
[[Pilt:Addition reactions general overview.svg|frame|center|Liitumisreaktsioonide |
[[Pilt:Addition reactions general overview.svg|frame|center|Liitumisreaktsioonide mehhanismid: 1) elektrofiilne liitumine, 2) nukleofiilne liitumine ja 3) radikaalne liitumine]] |
||
*[[elektrofiilne liitumine]] (tähistatakse Ad<sub>E</sub>; [[karbokatioon]]ne [[intermediaat]]) |
*[[elektrofiilne liitumine]] (tähistatakse Ad<sub>E</sub>; [[karbokatioon]]ne [[intermediaat]]) |
||
*[[nukleofiilne liitumine]] (tähistatakse Ad<sub>N</sub>; [[anioon]]ne intermediaat) |
*[[nukleofiilne liitumine]] (tähistatakse Ad<sub>N</sub>; [[anioon]]ne intermediaat) |
||
Viimane redaktsioon: 8. detsember 2021, kell 13:24
Liitumisreaktsioon on orgaaniline reaktsioon, milles kaks või enam molekuli ühinevad üheks suuremaks molekuliks.
Liitumisreaktsioonidesse astuvad kaksik- või kolmiksidet sisaldavad molekulid: alkeenid (C=C), alküünid (C≡C), karbonüülrühma (C=O), imiinrühma (C=N) jt sisaldavad ühendid. Näiteks etüleeni broomimine:
- H2C=CH2 + Br2 → BrH2C-CH2Br
Mehhanismid[muuda | muuda lähteteksti]
Olenevalt reaktsioonis osalevate ühendite keemilisest olemusest eristatakse nelja põhilist liitumisreaktsiooni mehhanismi:
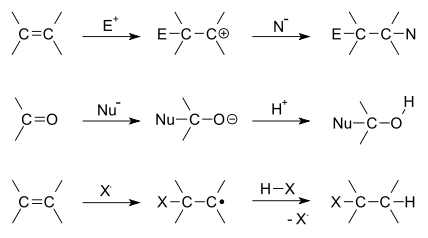
- elektrofiilne liitumine (tähistatakse AdE; karbokatioonne intermediaat)
- nukleofiilne liitumine (tähistatakse AdN; anioonne intermediaat)
- radikaalne liitumisreaktsioon (tähistatakse AdR; vaba radikaalne intermediaat)
- sünkroonliitumine (enamasti tsükloliitumine, näiteks Diels-Alderi reaktsioon))
Siia kuulub ka liitumispolümerisatsioon (ahelpolümerisatsioon), mille puhul aktiivse intermediaadi genereerimine (initsieerimine) toimub analoogselt eeltoodud mehhanismidega. Need on katioonne polümerisatsioon, anioonne polümerisatsioon, radikaalpolümerisatsioon ja koordinatsioonipolümerisatsioon.


Sün- ja anti-liitumine[muuda | muuda lähteteksti]
Orgaaniliste liitumisreaktsioonide korral tähendab sün-liitumine mõlema liituva rühma ühinemist kaksik- või kolmiksidemega ühelt ja samalt poolelt. Anti-liitumise korral ühinevad rühmad molekuliga selle vastaspooltelt.
Vaata ka[muuda | muuda lähteteksti]
| Pildid, videod ja helifailid Commonsis: Liitumisreaktsioonid |
- Sidestusreaktsioon
- Ühinemisreaktsioon
- Liitumis-elimineerimisreaktsioon (näiteks nukleofiilne atsüülasendusreaktsioon)
