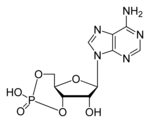
Tsükliline adenosiinmonofosfaat
| Tsükliline adenosiinmonofosfaat | |
|---|---|
| Üldised omadused | |
| Keemiline valem | C10H12N5O6P |
| Füüsikalised omadused | |
| Molekuli mass | 329.206 amü |
| Kasutatakse SI-süsteemi ühikuid. Kui pole teisiti öeldud, eeldatakse normaaltingimusi. | |
Tsükliline adenosiinmonofosfaat (cAMP, tsükliline AMP või 3',5'-tsükliline adenosiinmonofosfaat) on sekundaarne virgatsaine, mis osaleb paljudes bioloogilistes protsessides. cAMP sünteesitakseadenosiintrifosfaadist (ATP) ja see osaleb rakusiseses närvisignaali ülekandes.
Ajalugu
[muuda | muuda lähteteksti]Earl Wilbur Sutherland Jr., ameerika füsioloogiaprofessor, farmakoloog ja biokeemik, näitas 1950. aastatel, et glükogenolüüsi stimuleerib maksas adrenaliin (epinefriin), mis aktiveerib glükogeeni fosforülaasi. Esimest korda demonstreeriti, et hormoon mõjub kindlale ensüümile ja sealjuures on vahendajaks cAMP. 1971. aastal pälvis Sutherland selleteemaliste tööde eest Nobeli füsioloogia- või meditsiiniauhinna. 1992. aastal sai Nobeli auhinna ameerika biokeemik Edwin Krebs, kes oli aastaid uurinud cAMP-i osa signaali ülekandes, sealhulgas ka mõju insuliini toimele.
Süntees ja lagundamine
[muuda | muuda lähteteksti]cAMP sünteesitakse adenosiintrifosfaadist (ATP) plasmamembraani siseküljel asuva adenülaadi tsüklaasi (AC) abil. G-valgud reguleerivad rakusisese cAMP-i kontsentratsiooni, vahendades virgatsainete inhibeerivat või aktiveerivat toimet AC-le. Gs ehk stimuleerivate G-valkude perekond aktiveerib AC-d; Gi ehk inhibeerivate G-valkude perekond inhibeerib AC-d. Maksa adenülaadi tsüklaas reageerib tugevamini glükagoonile, lihaste adenülaadi tsüklaas adrenaliinile.
cAMP-i lagunemist AMP-ks katalüüsib ensüüm fosfodiesteraas.
Funktsioonid
[muuda | muuda lähteteksti]cAMP on sekundaarne virgatsaine, mis vahendab mitmeid sünaptilise ülekande radasid, näiteks osaleb cAMP hormoonide (nagu glükagoon ja adrenaliin) signaalide ülekandes.
cAMP on seotud proteiinkinaaside aktivatsiooniga ja moduleerib adrenaliini ja glükagooni efekte.
Lisaks sellele reguleerib cAMP ka Ca2+ liikumist läbi ioonkanalite.
Eukarüootides
[muuda | muuda lähteteksti]cAMP ja sellega seotud kinaasid mängivad olulist rolli mitmetes biokeemilistes protsessides, sealhulgas glükogeeni, suhkru ja lipiidide metabolismi regulatsioonis.
Inimorganismis aktiveerib cAMP proteiinkinaasi A (PKA). Holoensüüm PKA koosneb puhkeolekus kahest katalüütilisest (C) alaühikust, mis on seotud dimeerse regulatoorse (R) alaühikuga. Nelja aktiveeriva ligandi ehk cAMP-i seostumisel regulatoorsetele alaühikutele (mõlemale 2 cAMP-i molekuli) toimub molekulis konformatsiooniline muutus, mille tagajärjel dissotsieerub holoensüüm kaheks C-alaühikuks ja nelja cAMP-i molekuliga dimeerseks R-alaühikuks. Vabad C-alaühikud muutuvad katalüütiliselt aktiivseks ning on võimelised fosforüülima substraatvalke.
Aktiveeritud alaühikud fosforüülivad seriini ja treoniini jääke mitmetes substraatvalkudes. Fosforüülitud valgud võivad toimida otse raku ioonkanalitele või muutuda aktiveeritud või inhibeeritud ensüümideks.
Proteiinkinaas A fosforüülib ka spetsiifilisi valke, mis seonduvad DNA promootoraladele. See põhjustab vastavate geenide ekspressiooni suurenemist.
Mitu proteiinkinaaside klassi, sealhulgas proteiinkinaas C, ei ole cAMP-sõltuvad. cAMP-i teised toimed sõltuvad peamiselt cAMP-sõltuvatest proteiinkinaasidest, mis varieeruvad rakutüübiti.[1]
Arusaam, et PKA vahendab suuremat osa cAMP-i funktsioonidest, on aegunud. 1998. aastal avastati G-valkude perekonda kuuluvad cAMP-reguleeritud guaniinnukleotiidide vahetusfaktorid (GEF). Neid nimetatakse Epac-valkudeks (Exchange proteins activated by cAMP). On teada kaks Epac-valgu isovormi. Nende aktivatsioonimehhanism sarnaneb PKA-le: valgul on N-terminaalne regulatoorne ala ja C-terminaalne katalüütiline ala. Kui cAMP seondub N-terminaalsele domeenile, siis see dissotsieerub ja paljastab katalüütilise GEF-domeeni. Selle tagajärjel aktiveerib Epac Ras superperekonda kuuluvaid väikeseid GTP-aase, näiteks Rap1.
Teistes elusorganismides
[muuda | muuda lähteteksti]cAMP-i roll bakterites
[muuda | muuda lähteteksti]Bakterirakus varieerub cAMP-i sisaldus sõltuvalt kasvukeskkonnast. cAMP-i sisaldus on väike, kui süsinikuallikaks on glükoos. Seda põhjustab adenülaadi tsüklaasi inhibitsioon glükoosi rakku transportimisel.
Transkriptsioonifaktor CRP (cAMP receptor protein), mida nimetatakse ka CAP-ks (catabolite gene activator protein), moodustab cAMP-iga kompleksi, mille järel saab ta seonduda DNA-le. CRP-cAMP suurendab DNA-le seondudes mitmete geenide ekspressiooni. Nende hulgas on geene, mis kodeerivad ensüüme, mille abil saab rakk toota energiat ka ilma glükoosita.
cAMP on seotud näiteks lac-operoni positiivse regulatsiooniga. cAMP akumuleerub rakku väikese glükoosisisaldusega keskkonnas ja seondub transkriptsiooni aktivaatorvalgu CRP allosteerilise alaga. CRP aktiveerub ja seondub DNA-le lac-promootorist ülesvoolu, võimaldades RNA polümeraasil kergemini promootorile kinnituda. See muudab lac-operoni transkribeerimise kiiremaks. Suure glükoosi kontsentratsiooni juures cAMP-i kontsentratsioon väheneb ja CRP eraldub lac-operonist.
cAMP-i roll mõnedes limaseentes
[muuda | muuda lähteteksti]Teatud limaseente liikidel, näiteks Dictyostelium discoideumon, juhivad rakkude kemotaktilist liikumist cAMP-i lained, mis levivad perioodiliselt rakkude vahel. Lained tekivad cAMP-i reguleeritud sünteesil ja rakkudest eritamisel ning spontaanse bioloogilise ostsillaatori abil, mis laineid algatab.
Patoloogia
[muuda | muuda lähteteksti]cAMP-i roll inimese vähkkasvajates
[muuda | muuda lähteteksti]On välja pakutud, et cAMP-i radade regulatsiooni häirumine ja cAMP-i mõjutatavate geenide hälbiv aktiveerumine on seotud teatud vähkkasvajate arenguga.[2][3][4]
cAMP-i roll prefrontaalse korteksi häiretes
[muuda | muuda lähteteksti]On leitud, et cAMP mõjutab ioonkanalite regulatsiooni kaudu eesajukoores mõtlemisfunktsiooni. Neid ioonkanaleid nimetatakse hüperpolarisatsiooniga aktiveeritavateks tsükliliste nukleotiidide reguleeritud kanaliteks (HCN – hyperpolarization-activated cyclic nucleotide-gated channels). Kui cAMP stimuleerib HCN-kanaleid, siis need avanevad, peatades ajuraku suhtluse teiste rakkudega ja seega takistades prefrontaalse korteksi funktsioneerimist. See nähtus on oluline aju-uuringute ja neuroloogia seisukohalt, näiteks uuritakse seda seoses kognitiivsete defitsiitidega, mis esinevad vananemise ja ADHD korral.[5]
Viited
[muuda | muuda lähteteksti]- ↑ GeneGlobe -> GHRH Signaling Retrieved on May 31, 2009
- ↑ American Association for Cancer Research (cAMP-responsive Genes and Tumor Progression)
- ↑ American Association for Cancer Research (cAMP Dysregulation and Melonoma)
- ↑ American Association for Cancer Research (cAMP-binding Proteins' Presence in Tumors)
- ↑ ScienceDaily ::Brain Networks Strengthened By Closing Ion Channels, Research Could Lead To ADHD Treatment