Neuroonkoloogia
See artikkel vajab toimetamist. (Aprill 2023) |

Neuroonkoloogia on meditsiini fookus, mis ühendab neuroloogia ja onkoloogia.
Neuroonkoloogia tegeleb peamiselt närvisüsteemi kasvajahaiguste diagnoosimise, ravi ja uurimisega, mis hõlmab järgmisi kasvajatüüpe:
- kesknärvisüsteemi primaarsed kasvajad (ajukasvajad ja seljaaju kasvajad)
- kesknärvisüsteemi sekundaarsed kasvajad (metastaasid ajus ja seljaaju metastaasid)
- kesknärvisüsteemi pahaloomulised lümfoomid
- Perifeerse närvisüsteemi kasvajad
Juba see loetelu näitab, et tegemist on laia valdkonnaga, mida on raske määratleda. Kui ka kesknärvi lümfoomide ravis järgitakse hematoloogilise ravi juhiseid ja ajumetastaase ei ravita primaarse kasvaja põhiravist eraldi, siis perifeersete närvide kasvajad on healoomulised, nagu neurinoomid, ja nagu teised pehmete kudede kasvajad, mis sageli paiknevad ortopeedia valdkonnas.
Üldine informatsioon
[muuda | muuda lähteteksti]Kesknärvisüsteemi esmased kasvajad
[muuda | muuda lähteteksti]Primaarsed ajukasvajad võivad tekkida igas vanuses, alates imikueast kuni hilise elueani. Diferentsiaaldiagnoosimisel on abiks sellised tegurid nagu vanus, kasvaja asukoht ja kliiniline pilt. Enamik primaarsete ajukasvajate tüüpe esineb sagedamini meestel, välja arvatud meningioomid, mida esineb sagedamini naistel.
Kesknärvisüsteemi metastaatilised kasvajad
[muuda | muuda lähteteksti]Pidevate kudede otsene invasioon või kokkusurumine on seotud närvisüsteemi lähedusega teistele struktuuridele.
Intrakraniaalsed metastaasid
[muuda | muuda lähteteksti]Intrakraniaalseid metastaase on kolme tüüpi: Aju metastaasid, duraalsed metastaasid ja meningeaal-leptomeningeaalsed metastaasid. Aju metastaasid võivad olla ühe- või mitmekordsed ja mõjutada mis tahes ajuosa. Metastaasid duraalsetesse struktuuridesse tekivad tavaliselt hematogeense leviku või otsese invasiooni teel külgnevast luust. Duraalsed metastaasid võivad tungida põhiajusse ja põhjustada fokaalset turset ja sellega seotud neuroloogilisi sümptomeid. Ajukoore asukoha tõttu kipuvad need protsessid põhjustama krampe juba varakult. Leptomeningeaalsed metastaasid on vähihaigetel haruldane, kuid hästi tunnustatud kliiniline nähtus. Leptomeningeaalsed metastaasid on kõige sagedamini tingitud rinna-, kopsu- või melanoomi primaarsetest kasvajatest.
Kolju metastaasid
[muuda | muuda lähteteksti]Kolju metastaasid jagunevad kahte kategooriasse: Kalvarium ja koljupõhi.
Kesknärvisüsteemi esmased kasvajad
[muuda | muuda lähteteksti]Kesknärvisüsteemi (KNS) kasvajate esimene alajaotus esineb primaarsete (pärinevad otse kesknärvisüsteemist) ja metastaatiliste (mis pärinevad teisest elundist) kasvajate vahel. Viimaste esinemissagedus on ligikaudu kümme korda suurem kui esimestel. Ajukasvajad on ajus arenevad kasvajad. Kasvajaid, nagu meningioom, mis oma massi tõttu surub kokku, kuid ei tungi ajju, ning ajutüvel paiknevaid hüpofüüsi ja epifüüsi kasvajaid nimetatakse sageli valesti ajukasvajateks . Mõiste intrakraniaalsed kasvajad võtab need täpsemalt kokku.
Primaarsed kesknärvisüsteemi kasvajad hõlmavad mitmesuguseid patoloogilisi üksusi, millest igaühel on oma loomulik ajalugu. Tulenevalt asjaolust, et ainuüksi gliaalkasvajaid on peaaegu 40 protsenti nendest kasvajatest, saab esmalt eristada gliaalkasvajaid (glioomid) ja mittegliaalkasvajaid. Kõige levinumad glioomid on astrotsütoomid (pärinevad gliia astrotsüütide rakkudest), oligodendroglioomid (pärinevad oligodendrogliiarakkudest) ja ependümoomid (pärinevad ependümaalsetest rakkudest).
Epidemioloogia
[muuda | muuda lähteteksti]Kesknärvisüsteemi pahaloomulised primaarsed kasvajad on suhteliselt haruldased ja moodustavad umbes 2 protsenti kõigist pahaloomulistest kasvajatest. Kesknärvisüsteemi kasvajahaigused jagunevad 95-ni protsenti ajus ja kuni 5 Protsent ajukelme, kraniaalnärvide ja seljaaju kohta. Need võivad esineda igas vanuses ja haiguse tekkimise oht suureneb koos vanusega. Täiskasvanutel võib histoloogiliselt leida glioome, mis pärinevad närvirakkude tugikoest, millest umbes 75 protsenti glioblastoomidest Astrotsütoomid IV. kraadi ebasoodsa prognoosiga. Embrüonaalsed kasvajad domineerivad imikutel ja väikelastel. Saksamaal haigestus 2016. aastal umbes 3970 inimest mehed ja 3460 Kesknärvisüsteemi pahaloomuliste kasvajatega naised. Keskmine ellujäämismäär on 21 protsenti meestel ja 24 protsenti naistele. Statistika hõlmab harva ka histoloogiliselt healoomulisi kesknärvisüsteemi kasvajaid, mida esineb ligikaudu 6000. uued juhtumid per aasta vale. Umbes 65 Protsent sellest pärineb ajukelmetest. Naised kannatavad palju sagedamini. Kui neid ei ravita kirurgilise või kiiritusraviga, võivad isegi healoomulised kasvajad lõppeda surmaga suletud koljuruumi progresseeruva kasvu tõttu. Kõige tavalisem pahaloomuline intrakraniaalne kesknärvisüsteemi kasvaja on glioblastoom, kõige levinum healoomuline meningioom.
Etioloogia
[muuda | muuda lähteteksti]Geneetiline eelsoodumus kesknärvisüsteemi kasvajate tekkeks on suhteliselt haruldane, kuigi mõned glioomid võivad tekkida mitme perekondliku häire tüsistustena.
Mõnede kasvaja supressorgeenide mutatsioon iseloomustab mitmeid pärilikke sündroome, mis näitavad suurenenud vastuvõtlikkust ajukasvajate tekkele. Järgmised mutatsioonid ja nende sündroomid on seotud suurema riskiga ajukasvajate tekkeks: NF1 geenimutatsioon 1. tüüpi neurofibromatoosiga, APC mutatsioon Turcot sündroomiga, PTCH mutatsioon Gorlini sündroomiga ja TP53 või CHEK2 - Mutatsioon Li-Fraumeni sündroomiga.
Primaarsete ajukasvajatega seotud keskkonnategureid on raske tuvastada. Mõnedes uuringutes on kokkupuudet vinüülkloriidiga seostatud kõrgekvaliteedilise glioomi esinemissageduse suurenemisega. Ainus haruldane, kuid hästi tuvastatud primaarse ajukasvaja põhjus on ioniseeriv kiirgus. Eelkõige on tinea capitisiga laste ja ägeda lümfoidse leukeemia, kraniofarüngioomi või mitte-Hodgkini lümfoomiga patsientide kiiritusravi seotud suurenenud glioomiriskiga. AIDS-i patsientidel on suurenenud risk primaarse ajulümfoomi tekkeks.
Kliinik
[muuda | muuda lähteteksti]Märgid ja sümptomid
[muuda | muuda lähteteksti]Aju neoplaasia sümptomeid iseloomustab nihkumine või Ümbritsevate kudede hävitamine ja samade põhjuste infiltratsioon.
Kõige tavalisem sümptom, millest teatab 35 protsenti patsientidest, on peavalu . Tugevate peavalude esinemine patsientidel, kes seda muidu harva põevad, on sageli iseloomulikud, eriti kui peavaluhood või migreen on tugevamad hommikuti ning nendega kaasnevad iiveldus, oksendamine ja neuroloogiline puudulikkus. Patsientidel, kes kannatavad sagedamini peavalude all, võib ajukasvaja arengu sümptomiks olla kuju muutus, rünnakute sageduse või intensiivsuse suurenemine. Krambid esinevad ligikaudu kolmandikul glioomiga patsientidest, eriti madala raskusastmega või kesknärvisüsteemi kasvajatega. Fokaalne neuroloogiline defitsiit on seotud kasvaja asukohaga. Vaimse seisundi muutused esinevad ka 15–20 protsendil glioomiga patsientidest.
Pildidiagnostika
[muuda | muuda lähteteksti]
Kompuutertomograafia (CT) ja magnetresonantstomograafia (MRI) võimaldavad tõhusalt tuvastada neoplaasiat ajus. MRI on kahjustuste tuvastamiseks tundlikum kui CT, kuid sellel on vastunäidustused patsientidele, kellel on südamestimulaatorid, kokkusobimatud proteesid, metallklambrid ja muud. CT on endiselt valikmeetod kaltsifikatsioonide tuvastamiseks koljukatte või aluse kahjustustes või luu erosioonides. Kontrastainete kasutamine, mis on CT puhul joodeeritud ja MRI puhul paramagnetilised ( gadoliinium ), võimaldab hankida teavet vaskularisatsiooni ja hematoentsefaalbarjääri terviklikkuse kohta, mis on kasvaja kasvaja parem määratlus. ümbritsevale tursele ja hüpoteeside genereerimisele pahaloomulisuse astme kohta. Radioloogiline uuring võimaldab hinnata ka kasvajast tulenevaid mehaanilisi mõjusid ja sellest tulenevaid muutusi ajustruktuurides, nagu vesipea ja herniad, mille tagajärjed võivad lõppeda surmaga. Lõpuks, operatsiooni ettevalmistamisel saab seda diagnostikat kasutada kahjustuse asukoha või kasvaja infiltratsiooni määramiseks aju elutähtsatesse piirkondadesse. Sel eesmärgil on MRI tõhusam kui CT, kuna see võib anda kolmemõõtmelisi pilte.

Diagnostilised radioloogilised kuvamisvahendid toovad esile muutused neoplastilises koes võrreldes normaalse aju parenhüümiga (läbi elektrooniliselt pildistatud koe tiheduse muutuste CT-s ja signaali intensiivsuses MRI-s). Nagu enamik patoloogilisi kudesid, on kasvajad äratuntavad ka rakusisese vee suurenenud kogunemise järgi. Arvutitomogrammil näivad need hüpodensidena, st väiksema tihedusega kui aju parenhüüm, magnetresonantstomogrammil spin-võre lõdvestusega hüpointensiivne ja spin-spin-relaksatsioonis samuti prootoni kaalumine (PD) hüperintensiivne.
Röntgenpildil ei tohiks terve ajupiirkond erilist luminestsentsi näidata. Seetõttu on ütlematagi selge, et tähelepanu pööratakse suurematele kontrastsete signaalide vahemikele.
Üldiselt on kasvajakoes suurem osa kontrasti suurendamisest tingitud konkreetsest vere-kasvaja barjäärist, mis võimaldab joodi (CT) ja gadoliiniumi (MRI) läbimist kasvajasisesesse ekstravaskulaarsesse interstitsiaalsesse ruumi. See suurendab kasvaja signaali (tihedust või intensiivsust). Siiski tuleb hoolitseda selle eest, et kontrastsuse suurendamine ei eristaks lõplikult neoplaasiat haavade ödeemist. Tegelikult näitab anatoomilis-patoloogiline leid pahaloomulise infiltreeruva glioomi kasvajakoes, nagu glioblastoom ja anaplastiline astrotsütoom, lisaks vasogeensele tursele, mis on põhjustatud hematoentsefaalbarjääri hävitamisest kasvaja poolt. Viimane kliiniline seisund on diagnostilise pildistamise abil halvasti tuvastatav.
Aju kompuutertomograafia näitab tavaliselt koe massi, mida saab suurendada mõlema kontrastiga. CT-l paistavad madala kvaliteediga glioomid tavaliselt normaalse parenhüümiga võrdsed ja seetõttu ei pruugi kontrasti suurenemine ilmneda. Samamoodi on CT-ga raske tuvastada kolju tagumise lohu kahjustusi. Järelikult ei piisa diagnostilistel eesmärkidel alati ainult sellise tomograafia tulemustest. Kahtlastel juhtudel on hädavajalik kasutada tundlikumat magnetresonantstomograafiat.
Peal -MRI näitab intrakraniaalset kasvajat massiivse kahjustusena, mis võib pärast kontrastaine kasutamist luminestseeruda. Siiski on alati signaali anomaalia - Magnetresonantstomograafia, mis näitab neoplaasia või vasogeense turse olemasolu. Tavaliselt näitab suurenenud luminestsents (kontrastsuse suurendamine) kõrgema astme pahaloomulise kasvajaga kasvajat. Glioblastoomile on iseloomulik kontrastring, mille luminestsentsosa vastab pahaloomulise kasvaja elutähtsale osale ja tumedam. -koe nekroosile vastav hüpotensiline piirkond.
Lavastus
[muuda | muuda lähteteksti]Enamik primaarseid intrakraniaalseid kasvajaid lokaliseerub koljus, seega pole süsteemseid staadiumis protseduure vaja. Seevastu primaarsed neuroektodermaalsed kasvajad, medulloblastoomid, kesknärvisüsteemi idurakkude kasvajad ja primaarsed kesknärvisüsteemi lümfoomid levivad sageli subarahnoidse ruumi kaudu leptomeningesse. Seetõttu on kõigil sellise diagnoosiga patsientidel vaja teha spinaalne magnetresonantstomograafia või lumbaalpunktsioon.
Kasvaja tüübid
[muuda | muuda lähteteksti]Glioomid
[muuda | muuda lähteteksti]Primaarsed kesknärvisüsteemi (KNS) kasvajad hõlmavad mitmesuguseid patoloogilisi kudesid, millest igaühel on oma loomulik ajalugu. Kuna ainuüksi glioomid moodustavad peaaegu 40 protsenti kõigist kesknärvisüsteemi kasvajatest, on kirjanduses tavaline eristada gliaalseid ja mittegliaalseid kasvajaid.
Astrotsütoomid
[muuda | muuda lähteteksti]Astrotsütoomide pahaloomulisuse hindamiseks on kirjanduses aja jooksul pakutud erinevaid kategooriasüsteeme. Alates 1993. aastast on enim kasutatud ja rakendatud Maailma Terviseorganisatsiooni (WHO) välja pakutud neljatasemeline hindamissüsteem. See põhineb neljal histoloogilisel tunnusel: suurenenud rakutihedus, mitoos, endoteeli proliferatsioon ja nekroos. Seejärel on I astme astrotsütoomid, nagu pilotsüütilised astrotsütoomid, tavaliselt healoomulised. Astrotsütoomid II. Graad (hajutatud) näitavad ainsa histoloogilise tunnusena suurenenud rakkude tihedust ja on väiksema infiltratsiooniastmega kasvajad. Astrotsütoomid III näitavad märkimisväärset mitoosi. klass (anaplastiline). IV astme astrotsütoomid ehk niinimetatud glioblastoomiden on äratuntavad.
Madala astme astrotsütoomid
[muuda | muuda lähteteksti]
Piiratud kasvajate hulka kuuluvad pilotsüütilised astrotsütoomid (sealhulgas pilomüksoidne aastrotsütoom ), subependümaalsed hiidrakulised astrotsütoomid ja pleomorfsed ksanastrotsütoomid. Need on mõnevõrra haruldasemad healoomulise histoloogilise kasvajaga kasvajad, mida saab sageli ravida ainult operatsiooniga. Kui ekstsisioon on mittetäielik, saab ülejäänud kasvajakudet edukalt ravida kiiritusraviga . Harvadel juhtudel, kui lokaalne ravi ei anna tulemusi, võib edukaks osutuda süsteemne keemiaravi, mida tuleb individuaalselt kohandada. Lapsed reageerivad karboplatiini ja vinkristiini kombinatsioonile. Kompuutertomograafial ilmnevad difuussed astrotsütoomid II. Hinne kui vähem intensiivsed kahjustused. Eelistatud magnetresonantstomograafias ei pruugi kontrastained neid kasvajaid esile tuua, nende luminestsents võib olla õhem ja nõrgem. Intensiivsem võib viidata suurenenud anaplaasia kudedele. Võimaluse korral tehakse kasvaja anaplastilisest osast proovide võtmiseks biopsia.


Enamikul juhtudel on difuusse astrotsütoomiga patsiendid vanuses 20–40 aastat. Epilepsiahoogude esinemine on neile tüüpiline. Soodsa prognoosi tingimused on noor vanus, kasvaja suurus alla 50 millimeetri ja kasvaja võimalikult ulatuslik kirurgiline resektsioon. Hilised retsidiivid on suhteliselt tavalised, mistõttu tuleb patsiente jälgida 15 aastat pärast kasvaja eemaldamist.
Vaatamata suhteliselt aeglasele kulgemisele areneb enamik astrotsütoome kahjustusteks, mida iseloomustab ulatuslik anaplaasia, mis tavaliselt ei allu operatsioonile ja kiiritusravile. Kuid difuusse madala astme astrotsütoomiga patsientide ravi ei näita kirjanduses ühehäälset üksmeelt. Täieliku resektsiooni rolli arutatakse professionaalses kontekstis. Mõnede uuringute tulemused näitavad, et kasvaja maksimaalne eemaldamine annab parima tulemuse. Tegelikult saab väikesed ja ühepoolsed kasvajad täielikult eemaldada, kui aju kriitilisi struktuure pole kaasatud. Pragmaatiline lähenemisviis, mis on üldiselt vastuvõetav juhtumite üldiseks jaoks, on neoplaasia võimalikult kaugele eemaldamine, et vältida olulisi neuroloogilisi puudujääke.
Uuringud on näidanud, et vahetult pärast diagnoosi tehtud kiiritusravi on pikendanud patsiendi haigusvaba aega enne kasvaja taastumist võrreldes olukorraga, kus kiiritusravi kulg lükkub edasi progresseerumiseni. Siiski ei ole praegu üksmeelt, et kiiritusravi vahetult pärast diagnoosi parandab patsiendi üldist elulemust.
Leebemate sümptomitega või ilma sümptomiteta või krambihoogudega patsientidel, mida saab krambihoogudevastaste ravimitega kontrollida, on võimalik kiiritusravi edasi lükata, kuni kasvaja kasv jõuab kriitilisse faasi. Sageli soovitakse vähendada kiiritusravi enda põhjustatud neuroloogiliste kahjustuste riski.
Kaks prospektiivset randomiseeritud kliinilist uuringut ei näidanud suurema annusega kiiritusravist suuremat kasu kui väikese annusega kiiritusravist. Tavaliselt on koguannus vahemikus 45 kuni 54 halli, fraktsiooniga 1,8 kuni 2 halli.
Adjuvantkemoteraapia mõju madala astme astrotsütoomiga patsientidele on endiselt uurimisel. Kliinilise uuringu esialgsed tulemused, milles võrreldi kiiritusravi ainult kiiritusraviga, millele järgnes prokarbasiini, lomustiini ja vinkristiini (PCV) sisaldav keemiaravi, näitasid kombinatsiooniga pikemat "haigusvaba elulemust", kuid mitte pikemat "üldist elulemust". PCV-protokolliga seotud toksilisuse tõttu on temosolomiidi kasutamine soovitatav nii esmase ravina kui ka pärast taastumist.
Anaplastilised astrotsütoomid
[muuda | muuda lähteteksti]
Anaplastiline astrotsütoom on pahaloomuline ajukasvaja, mida iseloomustab difuusne kasv, suurenenud rakkude tihedus ja tuumade jagunemise arv. See tuleneb kesknärvisüsteemi spetsiifilisest rakupopulatsioonist, astrotsüütidest. Vastavalt WHO kesknärvisüsteemi kasvajate klassifikatsioonile vastab kasvaja III astme kasvajale.
Tavaliselt esinevad anaplastilise astrotsütoomiga patsientidel epilepsiahood, fokaalsed neuroloogilised häired, peavalud ja isiksuse muutused. Patsiendi keskmine vanus on 45 aastat. Magnetresonantstomograafia näitab üldiselt ulatuslikku kahjustust koos suurenenud kontrastsignaaliga, mis võib olla ka nõrgem. Diagnoosiks on kahjustuse histoloogiline uurimine biopsia või kirurgilise resektsiooni teel.
Halvem prognoos võib olla seotud kõrge vanuse, kehva füüsilise seisundi ja oluliste neuroloogiliste kahjustustega. Üldiselt on terapeutiline tulemus parem täieliku kirurgilise resektsiooniga (standardravi) ilma neuroloogilisi puudujääke suurendamata. Kiiritusravi on standardne, kuna on näidatud, et see pikendab ellujäämisaega. Keemiaravi roll on vastuoluline.
Glioblastoom
[muuda | muuda lähteteksti] Pikemalt artiklis Glioblastoom
Pikemalt artiklis Glioblastoom

Kõige levinumad ja pahaloomulised gliiarakk-kasvajad on glioblastoomid. Need koosnevad peamiselt täiskasvanutel halvasti diferentseerunud astrotsütoomirakkude heterogeensest massist. Tavaliselt esinevad need ajupoolkerades, harvemini ajutüves või seljaajus. Välja arvatud väga harvadel juhtudel, nagu kõik ajukasvajad, ei ulatu need väljapoole kesknärvisüsteemi struktuure.
Glioblastoom võib tekkida difuussest (II. aste) või anaplastiline astrotsütoom (III. hinne) arendada. Viimasel juhul nimetatakse seda sekundaarseks. Kui see aga esineb ilma eelneva pahaloomulise kasvaja tunnusteta, nimetatakse seda esmaseks. Glioblastoomi ravitakse kirurgia, kiiritusravi ja keemiaraviga. Neid on raske ravida ja vähesed juhtumid jäävad ellu üle kolme aasta.
Oligodendroglioomid
[muuda | muuda lähteteksti]Oligodendroglioom on harvaesinev gliaalne ajukasvaja, mis tekib oligodendrotsüütidest. Seda esineb peamiselt 40–45-aastastel täiskasvanutel, eelistatavalt ajukoores ja ajupoolkerade valgeaines.
Oligodendroglioomid on suhteliselt haruldased, moodustades vähem kui umbes 5 protsenti kõigist primaarsetest ajukasvajatest ja mitte rohkem kui umbes 10–15 protsenti kõigist glioomidest. Need kasvajad jagunevad madala kvaliteediga ja anaplastilisteks kahjustusteks. Anaplastilist oligodendroglioomi iseloomustab suurenenud rakutihedus, mitoos, endoteeli proliferatsioon ja tuumapolümorfism ning nekroos.
Madala astme oligodendroglioomid ja oligoastrotsütoomid
[muuda | muuda lähteteksti]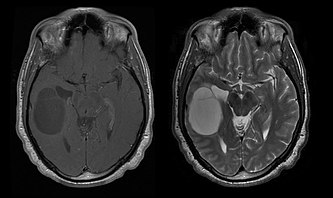
Puhta oligodendroglioomiga patsientide keskmine elulemus on umbes 10 aastat ja oligoastrotsütoomiga umbes 8 aastat. Pikendus võrreldes puhaste astrotsütoomidega on tingitud 1p/19q paari deletsioonist või translokatsioonist kasvajas. Patsientide keskmine vanus diagnoosimisel on 35 aastat. Tüüpilised sümptomid on epilepsiahood, kuid võib esineda ka fokaalseid neuroloogilisi puudujääke, isiksuse muutusi või muid intrakraniaalse rõhu sümptomeid, nagu peavalu ja oksendamine. Need kasvajad ei ole tavaliselt kompuuter-tomograafial nähtavad, seega on diagnostilise pildistamise valikmeetod MRI. Peal Magnet-resonantstomograafia, need on äratuntavad kui suurenenud signaali intensiivsus. Peal -pildid, seevastu saab signaali summutada ja kontrasti suurenemist saab tuvastada vaid aeg-ajalt. Lupjumise signaal võib puududa. Need kasvajad arenevad aeglasemalt kui madala kvaliteediga astrotsütoomid ja kirjanduses puudub üksmeel optimaalse ravi osas. Esialgne ravi hõlmab sümptomite kontrollimist krambivastaste ravimite, kiirituse, keemiaravi või kahe viimase kombinatsiooniga. Kirurgia, kiiritusravi ja keemiaravi mängivad olulist rolli ägenemiste korral. Resektsioonid võivad sümptomeid leevendada. Temosolomiid näitas 50 Protsent patsientidest, kes pärast kiiritusravi retsidiivid, on positiivse reaktsiooniga.
Anaplastilised oligodendroglioomid ja oligoastrotsütoomid
[muuda | muuda lähteteksti] Pikemalt artiklis Anaplastiline oligodendroglioom
Pikemalt artiklis Anaplastiline oligodendroglioom
Anaplastilistel oligodendroglioomidel on tüüpilised sümptomid, mis tulenevad massiefektist ja epilepsiahoogudest. Vaatamata nende kemosensitiivsusele on keskmine elulemus vaid 3 kuni 5 Aastaid. Ravi hõlmab võimalikult suurt väljalõikamist, millele järgneb kiiritusravi. Seoses keemiaraviga tuleb märkida, et kahes hiljutises III faasi kliinilises uuringus võrreldi kiiritusravi tulemusi kombineeritud kiiritusravi ja prokarbasiini, lomustiini ja vinkristiini keemiaravi tulemustega. Kuigi kombineeritud ravi korral oli elulemus ilma asjakohaste sümptomiteta pikem, oli üldine elulemus mõlema ravi puhul sama. Patsiendid, kellel oli deletsioon 1p/19q, saavutasid parimad ravitulemused, samas kui 1p/19q deletsioonita patsiendid suutsid PCV kemoteraapiaga oma tulemusi parandada.
Prospektiivsed kliinilised uuringud on näidanud, et umbes 50 kuni 70 Protsent patsientidest, kellel on pärast kiiritusravi korduv anaplastiline oligodendroglioom, reageerib positiivselt kemoteraapiale PCV või temosolomiidiga. Kuigi temosolomiidi ja PCV-ravi paremat efektiivsust ei ole kindlaks tehtud, viitab temosolomiidi kumulatiivse müelosupressiooni puudumine selle kasutamisele retsidiivi ravi alguses.
Ependümoomid
[muuda | muuda lähteteksti]
Ependümoom on kasvaja, mis areneb ependümaalsetest rakkudest, mis vooderdavad ajuvatsakesi, koroidpõimikut, filum terminale'i ja seljaaju keskkanalit. Ependümaalsed rakud esinevad ka aju parenhüümis embrüonaalse migratsiooni tagajärjel periventrikulaarsetest piirkondadest ajukooresse.
Need üsna haruldased kasvajad võivad ilmneda igas vanuses, kuid neil on kaks iseloomulikku tippu, 0 kuni 10 ja 40 kuni 50 aastat. Intrakraniaalsed vigastused, mis tekivad tavaliselt tagumises lohus, on sagedasemad esimeses vanuserühmas, selgroovigastused aga teises vanuserühmas.
Ependümoomid jagunevad madala raskusastmega kahjustusteks (I ja II. hinne WHO skaalal) ja anaplastilised kahjustused (III. kraadid) alajaotatud. I. aste on eelkõige subependümoomid ja müksopapillaarsed ependümoomid, III. Anaplastiline ependümoom. Patsiendid, kellel on lülisamba madala astme ependümoomid, mida saab täielikult eemaldada, ei saa pärast seda kiiritusravi. Postoperatiivse kiiritusravi roll madala raskusastmega intrakraniaalsete ependümoomide korral on vastuoluline, kuid kiiritusravi on tavaliselt näidustatud anaplastiliste või madala astme kasvajate korral, mida ei saa täielikult eemaldada.
Kliinilised uuringud on näidanud, et ependümoomid reageerivad keemiaravile, eriti plaatinapõhisele. Plaatinapõhise keemiaravi kasulikkus on 67 Protsent, teiselt poolt 25 nitrosouurea puhul protsenti. Ependümoomide prognoos II. Hinded on 6-aastane haigusvaba elulemus 68 protsenti ja üldise elulemusega 87 protsenti. Anaplastiliste ependümoomide korral langevad need väärtused 29-ni protsenti või 37-ni protsenti.
Mittegliaalsed kasvajad
[muuda | muuda lähteteksti]Medulloblastoomid
[muuda | muuda lähteteksti]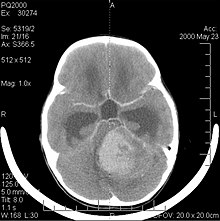
Medulloblastoom on kõige levinum pahaloomuline ajukasvaja lastel. Suurim esinemissagedus esineb lastel vanuses 2 kuni 7 aastat. Suurim risk haigestuda jääb lapsepõlves, kuna üle 21-aastastel inimestel esineb medulloblastoomi väga harva. See kasvaja on tüüpiline tagumisele lohule, kus see paikneb väikeaju mõlemas poolkeras või väikeaju vermis. Kuna see on invasiivne ja kiiresti kasvav, levib see tavaliselt CSF-i kaudu kesknärvisüsteemi (KNS) teistesse osadesse ja võib tungida lähedalasuva neljanda vatsakese põhja ja ajukelme. Harvemini võivad tekkida täiendavad kesknärvisüsteemi metastaasid. Pahaloomulise kasvaja ilmnemisel on sümptomiteks tasakaalukaotus, koordinatsioonihäired, diploopia, düsartria ja neljanda vatsakese haaratus, mille tagajärjeks on sageli obstruktiivne vesipea, peavalu, iiveldus ja oksendamine ning ebastabiilne kõnnak.
MRI näitab tavaliselt suurt kontrasti suurendavat kahjustust, mis hõlmab väikeaju. Nagu ülalpool mainitud, on medulloblastoomil kõrge kalduvus lokaalselt infiltreeruda leptomeningeesse ja levida läbi subarahnoidaalse ruumi, hõlmates vatsakesi, aju kumerust ja selgroo leptomeningeaalseid pindu. Järelikult on vaja kogu kraniospinaaltelg resonantsi viia.
Operatsiooni eesmärk on eemaldada võimalikult suur osa kahjustusest. Tegelikult põhjustavad operatsioonijärgsed jääkkasvajad halvema prognoosi. Samuti on ebasoodsa prognoosi esilekutsujaks kasvajarakkude olemasolu tserebrospinaalvedelikus või leptomeningeaalsete metastaaside resonantstuvastus. Ainuüksi operatsioon ei ole tavaliselt ravitav. Mõnel juhul võib aga tulemuseks olla kraniospinaaltelje terapeutiline kiiritamine, mis keskendub primaarsele kasvaja kohale. Keemiaravi lisamine pärast kiiritusravi suurendab paranemise määra. Koos vinkristiiniga kasutatakse plaatinapõhiseid ravimeid (tsisplatiin või karboplatiin), etoposiidi ja alküülivat ainet (tsüklofosfamiid või lomustiin). Sobiva ravi korral on medulloblastoomiga patsientide pika elulemuse juhud, mis on üle 3 aasta, vahemikus 60 kuni 60 aastat ja 80 protsenti.
Meningioomid
[muuda | muuda lähteteksti]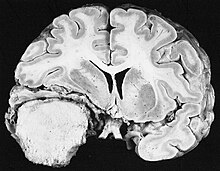

Meningioomid on kõige levinumad intrakraniaalsed välised või ekstraaksiaalsed ajukasvajad, mis tekivad arahnoidi rakkudest, aju ja seljaaju vooderdavast membraanist. Selle neoplaasia esinemissagedus on umbes 2 juhtumid kohta aasta kohta 100 000 Resident. Neid esineb sagedamini kuuendal ja seitsmendal kümnendil naistel. Nende esinemissagedus on kõrgem 2. tüüpi neurofibromatoosiga patsientidel. Kromosoomi kaotus 22 on iseloomulik meningioomidele, kuigi selle leiu prognostiline tähtsus on endiselt ebaselge.
Meningioomiga patsientidel võivad esineda sümptomid, mis on tüüpilised massiivsele koljukahjustusele, sealhulgas krambid ja fokaalsed neuroloogilised puudujäägid. Kuna meningioom võib olla ka asümptomaatiline, avastatakse need mõnikord kompuuter- ja magnetresonantstomograafial muudel põhjustel. Sellel resonantskasvajal on iseloomulik välimus, mis tavaliselt koosneb ühtlasest kontrastsuse suurenemisest piki kõvakestat, mis on selgelt eraldatud aju parenhüümist. Teine tunnus, kuigi mitte kõigil juhtudel, on niinimetatud "kõva saba", mida esindab punn, mis ulatub väljapoole kahjustust ja näitab kõvakesta kinnituspunkti.
Paljud juhuslikult avastatud meningioomid ei vaja esmase diagnoosimise ajal ravi. Kui leitakse, et patsiendil on märkimisväärne massiefekt, olenemata sümptomitest või mitte, on valitud ravi tavaliselt täielik resektsioon. Mayo Clinicsi stuudios, kus võrreldi kasvaja kontrolli määrasid pärast kirurgilist resektsiooni ja radiokirurgiat väikese kuni mõõduka intrakraniaalse meningioomiga ja massiefekti sümptomiteta patsientidel, andis radiokirurgia tulemuseks parema kontrolli (98 versus 88 protsenti) ja vähemate tüsistustega (10 versus 22 protsenti) võrreldes kirurgilise eemaldamisega.
Primaarsed kesknärvisüsteemi lümfoomid
[muuda | muuda lähteteksti]
Primaarne kesknärvisüsteemi lümfoom moodustab umbes 2 protsenti kuni 3 protsenti kõigist normaalse immuunsüsteemiga patsientide ajukasvajatest. Neid esineb sagedamini üle 55-aastastel meestel kuni 60 aastat üles. Peaaegu pooled lümfoomidest tekivad üle 60-aastastel patsientidel ja umbes veerand üle 70-aastastel patsientidel aastat üles. Esinemissagedus näib suurenevat vanusega, kuid põhjus on endiselt ebaselge. Nõrgenenud immuunsüsteemiga patsientidel on suurem risk kesknärvisüsteemi lümfoomi tekkeks, seega on elundisiirdamise läbinutel kaasasündinud immuunpuudulikkus või autoimmuunhaigus või nad on nakatunud inimese immuunpuudulikkuse viirusega. HIV-ga seotud aju lümfoomid on seotud Epsteini-Barri viirusega, eriti patsientidel, kelle CD4 lümfotsüütide arv on alla 500 rakud per kuupmillimeetrit veres. Enamik kesknärvisüsteemi lümfoome on difuussed suured B-rakulised lümfoomid.
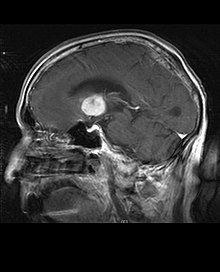
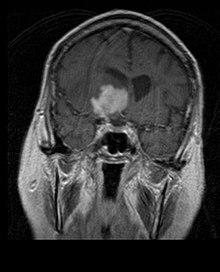
Patsiendid kannatavad mitmesuguste fokaalse või multifokaalse massiivse kahjustuse iseloomulike sümptomite all. MRI näitab tavaliselt homogeense kontrastsuse suurenemisega kasvajaid sügavas periventrikulaarses valgeaines. Nõrgenenud immuunsüsteemiga patsientidele on tüüpiline multifokaalsus ja ebahomogeenne võimendus. Kesknärvisüsteemi lümfoomi analüüs on aju neoplaasia diferentsiaaldiagnostikas äärmiselt oluline. Tuleb märkida, et kortikosteroidide manustamine võib viia täienduse täieliku kadumiseni, mis raskendab kahjustuste diagnoosimist. Järelikult, kui kesknärvisüsteemi lümfoomi tuleb diferentsiaaldiagnostikas arvesse võtta, tuleks kortikosteroide vältida, välja arvatud juhul, kui massiefekt põhjustab patsiendile tõsist ja vahetut probleemi.
Kahtlustatava kahjustuse biopsia on ülioluline. Erinevalt süsteemsest suurtest B-rakulistest lümfoomidest, mille puhul nii keemia- kui ka kiiritusravi on tõhusad ja lokaliseeritud kahjustuste ravi on raviv, reageerib kesknärvisüsteemi lümfoom tavaliselt esialgsele ravile, kuid kordub seejärel. Sarnaselt süsteemse lümfoomiga piirdub kirurgia peamiselt diagnoosimiseks sobivate koeproovide võtmisega.
Varem tehti kiiritusravi kogu ajule (panentsefaalne). Keskmine elulemus on umbes 12 isegi lokaliseeritud kahjustuste korral Kuud. Kordumine mõjutab tavaliselt nii eelmise vigastuse kohta kui ka teisi piirkondi. Keemiaravi vastused on paljutõotavamad. Kliinilised uuringud, kus esimese ravina kasutati ainult metotreksaati suurtes annustes ja kiiritusravi lükati edasi kuni retsidiivi või progresseerumiseni, näitasid paremat üldist elulemust kui ainult kiiritusravi. Veelgi tõhusam oli metotreksaadi, vinkristiini, prokarbasiini, intratekaalse metotreksaadi, tsütarabiini ja panentsefaalse kiiritusravi ja tsütarabiini kombinatsioon või intraarteriaalse kemoteraapia kasutamine koos intraarteriaalse metotreksaadiga, intravenoosselt süstitud tsüklofosfamiidi ja etoposiidiga pärast modifitseerimist veres. ajubarjäär mannitooliga. Keskmine elulemus metotreksaadiga ravis oli 24 kuni 40 kuud palju suurem kui ainult kiiritusravi korral (vahemik 24 kuni 40 kuud). Mõnel juhul kasutatakse kiiritusravi ainult ägenemiste korral, kui keemiaraviga kaasneb esialgne regressioon. Pika elulemuse juhtudest on teatatud ka ilma kiiritusravita.
Panentsefaalset kiiritusravi seostatakse suure riskiga dementsuse või leukoentsefalopaatia tekkeks. Seda riski saab vähendada tõhusate kasvajakontrolli strateegiate väljatöötamisega, mis väldivad panentsefaalset kiiritusravi. Kahjustatud immuunsüsteemiga patsientide esmaseks raviks on immuunsupressiooni põhjuste vähendamine. Nende patsientide prognoos on tavaliselt halvem kui normaalse immuunsüsteemiga patsientidel. Kaasnevate kasvajainfektsioonide ja üldiselt ebaoptimaalse füüsilise seisundi tõttu ei saa nendel immuunsupressiooniga patsientidel sageli keemiaravi läbi viia. Nagu ka teiste ajukasvajate puhul, sõltub ravivastus vanusest ja füüsilisest seisundist.
Kesknärvisüsteemi metastaatilised kasvajad
[muuda | muuda lähteteksti]Aju metastaasid
[muuda | muuda lähteteksti]
Aju metastaasid on täiskasvanutel kõige levinumad intrakraniaalsed kasvajad, mis on kümme korda tavalisemad kui primaarsed ajukasvajad. Nad astuvad 20 kuni 40 protsenti vähihaigetest täiskasvanutest ning neid seostatakse peamiselt kopsu- ja rinnavähi ning melanoomiga . Need kahjustused tulenevad vähirakkude levikust vereringe kaudu ja esinevad kõige sagedamini halli ja valge aine ristumiskohas, kus veresoonte ristlõige muutub, jäädes kinni kasvajarakkude emboolia . 80 protsent kahjustustest esineb ajupoolkerades, 15 protsenti väikeajus ja 5 protsenti ajutüves. Umbes 80 protsendil patsientidest on anamneesis süsteemne vähk ja 70 protsendil on mitu ajumetastaasi.
Nende kahjustuste diagnoosimisel ja ravil on viimasel ajal tehtud olulisi edusamme, mille tulemuseks on paranenud ellujäämine ja sümptomite kontroll. Märgid ja sümptomid on sarnased teiste massiivsete ajukahjustuste omadega. Valitud diagnostiline meetod on magnetresonantstomograafia kontrastaine abil.
Kirjanduses on toodud samaväärsed tulemused kirurgia ja radiokirurgia kohta. Viimane näib olevat mugavam, tõhusam ja ohutum väikeste kahjustuste või operatsioonide jaoks kättesaamatud piirkondade puhul. Radiokirurgia on mõistlik alternatiiv patsientidele, keda meditsiinilistel põhjustel opereerida ei saa. Operatsioon on aga selgelt optimaalne meetod diagnoosimiseks kudede saamiseks ja massiefekti põhjustavate kahjustuste eemaldamiseks. Seetõttu tuleks radiokirurgiat ja kirurgiat pidada kaheks teineteist täiendavaks, kuid erinevaks meetodiks, mida tuleb rakendada sõltuvalt patsiendi erinevast olukorrast. Peaaegu 50 eest protsenti ühe või kahe ajumetastaasiga patsientidest ei ole kahjustuste ligipääsmatuse, süsteemse haiguse ulatuse või muude tegurite tõttu kirurgilise eemaldamise kandidaadid. Neile ja teistele mitme metastaasiga patsientidele pakutakse tavaliselt standardravina panentsefaalset kiiritusravi. Tegelikult ulatub peaaegu 50-ni protsendil neist selle raviga paranesid neuroloogilised sümptomid ja 50 kuni 70 protsenti märgatav reaktsioon. [2] [3] [4] Kemoteraapiat kasutatakse harva peamiselt aju metastaaside korral.
Enamiku aju metastaasidega patsientide keskmine elulemus on pärast panentsefaalset kiiritusravi ainult neli kuni kuus kuud. Siiski võivad alla 60-aastased diskreetsete kahjustuste ja kontrollitud süsteemse haigusega patsiendid saavutada pikema elulemuse, kuna nad taluvad agressiivsemat ravi.
Meningeaalsed metastaasid
[muuda | muuda lähteteksti]
Umbes kell 5 protsendil kasvajapatsientidest saab diagnoosida metastaase pehmetes ajukelmetes (leptomeninges encephali). Kõige sagedamini esinevad need melanoomi, rinna- ja kopsuvähi korral kasvajarakkude vereringe kaudu levimise tagajärjel. Pahaloomulised rakud levivad seejärel kogu kesknärvisüsteemis (KNS), tavaliselt tserebrospinaalvedeliku kaudu, mida tavaliselt tuntakse ajuvedelikuna.
Üks või mitu järgmistest nähtudest ja sümptomitest võivad muu hulgas olla põhjustatud meningeaalsetest metastaasidest:
- lokaalsed närvikahjustused, nagu kraniaalnärvi halvatus, motoorne nõrkus ja radikulopaatia, paresteesia ja valu,
- otsene invasioon aju- või seljaaju kudedesse,
- Aju ja selgroo veresoonte häired koos fokaalsete neuroloogiliste häirete ja/või krambihoogudega,
- Tserebrospinaalvedeliku normaalse voolu takistused koos peavalu ja koljusisese rõhu tõusuga,
- Normaalse ajufunktsiooni häired, nagu entsefalopaatia ja/või
- perivaskulaarne infiltratsioon kasvajarakkude poolt, mille tulemuseks on isheemia ja apopleksia sümptomid.
Diagnoosi saab teha tserebrospinaalvedeliku uurimise või pea- ja seljaaju magnetresonantstomograafia abil. Pahaloomuliste rakkude olemasolu saab mõõta 50 juures protsenti patsientidest on võimalik tuvastada. Vähemalt 10 protsenti leptomeningeaalse haaratusega patsientidest jääb tsütoloogilisel uuringul negatiivseks. Suurendades lumbaalpunktsioonide arvu kuueni ja eemaldatud vedeliku kogust 10-ni Milliliter punktsiooni kohta võib suurendada positiivse diagnoosi võimalust. Tserebrospinaalvedelikus on valkude kontsentratsioon tavaliselt kõrge, glükoosi kontsentratsioon võib pleotsütoosi korral olla madal. Radiograafiline uuring võib näidata hüdrotsefaalia ilma ulatusliku kahjustuseta või leptomeningeside difuusse laienemiseta.
Ilma ravita on keskmine elulemus 4 kuni 6 nädalat, kus surm progresseeruva neuroloogilise seisundi halvenemise tõttu. Leptomeningeaalsed metastaasid on sageli põhihaiguse lõppstaadiumi ilming ning sümptomaatiline ravi võib olla sobivaim lahendus. Kortikosteroidid ja valuvaigistid pakuvad ajutist leevendust. Ravi võib pakkuda patsientidele, kellel on minimaalne süsteemne haigus ja vastuvõetav üldine füüsiline seisund, et leevendada sümptomeid ja pikendada elulemust.
Keskmist elulemust saab parandada kiiritusravi abil sümptomaatilistesse kohtadesse ja suuremahulistesse haigestunud piirkondadesse, mis on tuvastatud röntgenpildiga, ning intratekaalse raviga metotreksaadi, tsütarabiini ja tiotepaga, mis viiakse läbi lumbaalpunktsiooni või Ommaya kateetriga alates 3. 6 kuud suurendatakse.
Metotreksaadil põhineva intratekaalse ravi peamine tüsistus on nekrotiseeriv leukoentsefalopaatia, mis võib areneda pärast kuudepikkust ravi neil vähestel patsientidel, kes saavad nautida pikemat elulemust. See laastav toksiline toime on eriti levinud patsientidel, kes on saanud eelnevalt või samaaegselt kiiritusravi intratekaalse metotreksaadiga.
Valu ja lõplik ravi
[muuda | muuda lähteteksti]Palliatiivne ravi on ravi erivorm, mille eesmärk on parandada raske või eluohtliku haiguse, näiteks vähi all kannatavate patsientide elukvaliteeti. Palliatiivravi eesmärk ei ole ravida, vaid võimalikult varakult ennetada või ravida haiguse ja selle ravi sümptomeid ja kõrvaltoimeid ning sellega kaasnevaid psühholoogilisi, sotsiaalseid ja hingelisi probleeme. Palliatiivset ravi tuntakse ka kui mugavusravi, toetavat ravi ja sümptomite juhtimist.
Palliatiivset ravi osutatakse kogu patsiendi vähi põdemise aja vältel. Tavaliselt algab see diagnoosiga ja jätkub ravi, järelravi ja elu lõpuni.
Välislingid
[muuda | muuda lähteteksti]- www.cochrane.org/pt/evidence – COCHRANE - Neuro-Oncology Group
- www.eano.eu – European Association of Neuro-Oncology
- https://www.eortc.org/research_field/brain/ – The European Organisation for Research and Treatment of Cancer (EORTC)
Kirjandus
[muuda | muuda lähteteksti]- Jan C. Buckner et al., Central Nervous System Tumors, Mayo Clinic Proceedings, Jg. 82, 2007, lado 1271-1286
- Lisa M. DeAngelis et al., Intracranial Tumors. Diagnosis and Treatment, Dunitz London, 2002, ISBN 1-901865-37-1
- D. N. Louis et al., WHO Classification of Tumours of the Central Nervous System, Genf, 2007, ISBN 978-92-832-2430-3
- Richard Pazdur et al., Cancer management. A multidisciplinary approach. Medical, surgical, & radiation oncology, UBM Medica, 2010, ISBN 978-0-615-41824-7
- Jerome B. Posner, Neurologic Complications of Cancer, Davis, Philadelphia, 1995, ISBN 0-8036-0006-2
- Rüdiger Schenk, Neuroonkologische Therapiekonzepte zur Behandlung von Astrozytomen höheren Malignitätsgrades und Rezidivlokalisation, Regensburg, 2019
- Uwe Schlegel et al., Neuroonkologie, 2. erw., Thieme, Stuttgart, 2003, ISBN 3-13-109062-6
- Jörg-Christian Tonn et al., Oncology of CNS Tumors, Springer, Berlin, 2010, ISBN 978-3-642-02873-1


