Markovnikovi reegel: erinevus redaktsioonide vahel
P robot lisas: ru:Правила Марковникова |
Resümee puudub |
||
| 1. rida: | 1. rida: | ||
[[Image:MarkovnikovRulePropeneHBr.svg|right|frame|Broomvesiniku liitumine propeenile ]] |
[[Image:MarkovnikovRulePropeneHBr.svg|right|frame|Broomvesiniku liitumine propeenile ]] |
||
'''Markovnikovi reegli''' järgi toimub [[Orgaaniline keemia|orgaanilises keemias]] polaarse või polariseeritava [[molekul]]i E<sup>δ+</sup>–Z<sup>δ–</sup> liitumine [[alkeen]]idele või [[alküün]]idele. [[Elektrofiil]] (E<sup>+</sup> või H<sup>+</sup> või R<sup>+</sup> jt) liitub selle [[süsinik]]u aatomi juurde, millega on seotud rohkem [[vesinik]]u aatomeid ja [[nukleofiil]]ne rühm liitub selle süsiniku aatomiga, millega on seotud kõige vähem vesiniku aatomeid. Näiteks |
'''Markovnikovi reegli''' (ehk '''Markovnikovi seaduspärasuse''') järgi toimub [[Orgaaniline keemia|orgaanilises keemias]] polaarse või polariseeritava [[molekul]]i E<sup>δ+</sup>–Z<sup>δ–</sup> liitumine [[alkeen]]idele või [[alküün]]idele. [[Elektrofiil]] (E<sup>+</sup> või H<sup>+</sup> või R<sup>+</sup> jt) liitub selle [[süsinik]]u aatomi juurde, millega on seotud rohkem [[vesinik]]u aatomeid ja [[nukleofiil]]ne rühm liitub selle süsiniku aatomiga, millega on seotud kõige vähem vesiniku aatomeid. Näiteks |
||
HCl + CH<sub>2</sub>=CH–CH<sub>3</sub> → H<sub>3</sub>C–CHCl–CH<sub>3</sub> |
HCl + CH<sub>2</sub>=CH–CH<sub>3</sub> → H<sub>3</sub>C–CHCl–CH<sub>3</sub> |
||
Redaktsioon: 9. detsember 2009, kell 10:30
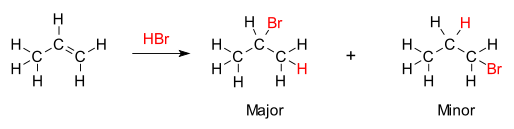
Markovnikovi reegli (ehk Markovnikovi seaduspärasuse) järgi toimub orgaanilises keemias polaarse või polariseeritava molekuli Eδ+–Zδ– liitumine alkeenidele või alküünidele. Elektrofiil (E+ või H+ või R+ jt) liitub selle süsiniku aatomi juurde, millega on seotud rohkem vesiniku aatomeid ja nukleofiilne rühm liitub selle süsiniku aatomiga, millega on seotud kõige vähem vesiniku aatomeid. Näiteks
HCl + CH2=CH–CH3 → H3C–CHCl–CH3
Taolise regioselektiivsuse tagab reaktsiooni esimeses vahestaadiumis kõige enam stabiliseeritud intermediaadi moodustumine. Elektrofiilse liitumise reaktsioonides on selleks kõige enam delokaliseeritud laenguga karbokatioon. Ülaltoodud reaktsioonis on selleks H3C–CHC+–CH3 aga mitte H2C+–CH2–CH3.
Liitumisele vastupidises protsessis - elimineerimisreaktsioonis moodustuvad produktid vastavuses Zaitsevi reegliga.
