Hambavaap
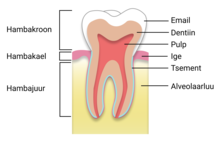
Hambavaap ehk email on atsellulaarne ehk mitterakuline, mineraalne kude, mis koosneb 96% anorgaanilisest ja 4% orgaanilisest komponendist ning veest ning katab hambakrooni[1].
Email on inimkeha tugevaim kude, mis katab seesmiselt paiknevat dentiinikude ning hambanärvi ehk pulpi. Tugevust on koel vaja selleks, et vastu pidada tugevatele jõududele, mis mälumisprotsessis tekivad[2]. Inimestel võivad mälumisjõud ulatuda 1000 njuutoni suurusjärku[3].
Emailikihi paksus varieerub vastavalt paiknemisele – kõige paksem emailikiht on mälumishammaste köprudel (u 2,5–3 mm), lõikehammaste otstes võib see olla mõnevõrra õhem (u 2 mm)[4].
Hambad paiknevad suuõõnes alveolaarharjadel ülalõualuus ja alalõualuus[5]. Inimesel on kaks hambakomplekti – 20 piimahammast ja 32 jäävhammast. Hammaste nähtavat osa nimetatakse krooniks, alveolaarluus paiknevat hamba osa nimetatakse juureks[6]. Hambavaap pole elus kude ja sellepärast on nii, et selle kulumise, kahjustuse või mõnel muul põhjusel hävinemise korral see ei taastu.
Hambakrooni katab pindmiselt tugev ja õhuke kiht emaili. Kõige suurema osa hamba struktuurist moodustab dentiin, mis paikneb emaili ja tsemendi all. Tsement on luusarnase struktuuriga kude, mis katab dentiini hamba juure osas[5].
Struktuur
[muuda | muuda lähteteksti]Emaili moodustavad 96–98% ulatuses hüdroksüapatiidi kristallid, mis on organiseerunud emailiprismadeks[5]. Emaili mineraalse osa moodustavad peale hüdroksüapatiidi veel karbonaadid ja erinevad elemendid, millega ollakse emaili arengustaadiumis kokku puutunud. Need võivad anda kaitsevõimet kaariesse tekke vastu, aga ka teha hamba vastuvõtlikumaks välistele mõjutajatele. Kariostaatilise potentsiaaliga on nendest elementidest fluor, boor, baarium ning kaariese teket pigem soodustavad on karbonaadid, raud ja plii[7].
Põhiliselt mineraalse koostisega hambaemaili suhteline tugevus Mohsi skaalas on 5.
Emailiprismad (prisma enameli) on emaili suurimad struktuursed komponendid ning neid võib olla olenevalt hambast 5–12 miljonit. Prismad on tihedalt pakitud ja omavahel põimunud ning iga emailiprisma ulatub dentiini-emaili piirilt kuni emaili pinnani. Emailiprismade perpendikulaarne asetus dentiini-emaili piiri suhtes kehtib nii piima- kui ka jäävhammaskonnas. Ainsaks erandiks on jäävhammaste kaelapiirkonnad, kus prismad on orienteeritud veidi apikaalsemas suunas[4]. Emailiprismade suunda on oluline arvesse võtta restauratsioonide prepareerimisel – toetuseta emailiprismad võivad olla marginaalse lekke põhjuseks ning seetõttu on hammas vastuvõtlikum sekundaarse kaariese tekkele[7].
Lisaks domineerivale anorgaanilisele komponendile on emaili koostises ka maatriksi valgud ja lipiidid[8]. Võrreldes areneva emailiga on küpse emaili mineraalne komponent märgatavalt väiksem. Sellest tulenevalt võib järeldada, et orgaanilist komponenti on peamiselt vaja emailikristallide arenguks ning edaspidi ei oma need nii suurt rolli. Arvatavalt on orgaanilise osa ülesanne emailiprismade omavaheline sidumine[7].
Kuigi lõikunud hamba email on atsellulaarne, siis ei ole see staatiline kude. Emaili mõjutavad süljenäärmete sekreteeritavad seedeensüümid, antikehad ja mitmed anorgaanilised komponendid[5].
Emaili areng
[muuda | muuda lähteteksti]Emaili arengu protsessi nimetatakse amelogeneesiks. Emaili teke on järkjärguline protsess, mille käigus orgaaniline maatriks asendatakse mineraalidega[9]. Emaili areng saab alguse enne hamba lõikumist piiratud ekstratsellulaarses keskkonnas, mis jääb dentiini ja seda katva ameloblastide kihi vahele. Email hakkab arenema inimesel raseduse kolmandal trimestril ning mineralisatsioon lõpeb kuus kuud pärast sündi[10].
Amelogenees toimub kahes suuremas etapis: sekretoorne faas ja küpsemisfaas. Sekretoorse faasi käigus toimub ameloblastides proteiinimaatriksi kogunemine, milles tekivad emailikristallid. Küpsemisfaasis emailikristallid suurenevad ning maatriks lagundatakse proteolüütiliste ensüümide poolt[11].
Sekretoorne faas
[muuda | muuda lähteteksti]Peamised valgud, mis võtavad osa emaili moodustamisest ekstratsellulaarses maatriksis on amelogeniin, ameloblastiin ja enameliin[12]. Sekretoorse faasi ameloblastid on pikad kolumnaarsed epiteliaalsed rakud, mida iseloomustavad histoloogilised struktuurid Tomesi jätked. Tomesi jätkete peamine funktsioon on emailivalkude suuremahuline tootmine ja sekretsioon[10]. Tomesi jätked organiseerivad emailikristallid prismadeks ja prismadevaheliseks emailiks. Mineraalide ladestumine toimub mineralisatsiooni frondil, mis paikneb ameloblasti membraani läheduses [13].
Emailikristallide kasv sekretoorses faasis toimub kasvutsüklitena, mis on nähtavad kasvujoontena. Kõige prominentsemad kasvujooned tekivad umbes iga üheksa päeva järel ning neid nimetatakse Retzinuse kasvujoonteks[13].
Üleminekul sekretoorsest faasist küpsemise faasi surevad ligi 25% ameloblastidest apoptoosi läbi[12]. Rakkudel toimub mitmeid struktuurilisi muutusi, näiteks kaovad Tomesi jätked ning sekretoorne aktiivsus väheneb.[10] Kui viimane kiht aprismaatilist emaili on moodustunud, siis emailikristallid enam pikkuses ei kasva. Edaspidi toimub nende kasv vaid laiuses ja paksuses[12].
Küpsemise ehk maturatsiooni faas
[muuda | muuda lähteteksti]Küpsemise faasi ameloblastid on lühemad, kui sekretoorse faasi ameloblastid. Selles faasis on nende ülesanneteks ioonide transport, happe-aluse tasakaalu säilitamine, ekstratsellullarse maatriksi valkude lagundamine, endotsütoos ja apoptoos[14].
Küpsemise faasis toimuvad raku morfoloogias jätkuvalt suured muutused, sest rakkudes hakkab toimuma suuremahuline valkude degradatsioon ja kiire kristallide kasv. Selle faasi ameloblaste iseloomustavad perioodiliselt vahelduvad lainelised ja siledad alad[10]. Küpsemise faasis puudub emailiorganis stratum intermedium, mille rakud sekretoorses faasis on ameloblastidega külgnevad. Selle asemel on ameloblastidega vahetult külgnevad tähekujulised papillaarrakud. Selle faasi ameloblaste ning papillaarrakke iseloomustavad rohked mitokondrid. Nende arvukus viitab sellele, et küpsemise faasis toimuvad protsessid vajavad rohkelt energiat [5].
Emaili lõpliku tugevuse saavutamisel mängib olulist rolli seriinproteaas kallikreiin 4 (KLK4), mille põhiülesandeks on amelogeniini degradeerimine. KLK4 düsfunktsioon võib põhjustada emaili hüpomaturatsiooni, mida peetakse ka üheks Amelogenesis imperfecta tekkepõhjuseks [15].
Emaili demineralisatioon
[muuda | muuda lähteteksti]Hambaemail on küll kõige tugevam kude ning seda aitab kaitsta ka suukeskkond, kuid mitmed tegurid põhjustavad emaili mineraalide kadu ning seeläbi emailikihi õhenemist. Peamiselt on mõjutavateks faktoriteks suus esinevate bakterite happetootlus ja hambakudede patoloogilise kulumise protsessid[16].
Kaariesekahjustus
[muuda | muuda lähteteksti]Hambakatus olevad bakterid metaboliseerivad toiduga saadavaid süsivesikuid ning toodavad nendest orgaanilisi happeid, mis langetab katu pH-d. Kui pH langeb alla kriitilise piiri, hakkab email demineraliseeruma[16]. Emaili remineraliseerumine pH normaliseerumisel toimub süljes esineva kaltsiumi ja fosfaadi pideval ladestumisel emaili pinnale. Kui toimub edasine biokile kogunemine ja süsivesikutega kokkupuude, ei suudeta enam emaili remineraliseerida ning tekib esmane kahjustus – laigustaadium. Edasist kaariese progresseerumist mõjutavad väga paljud tegurid ning dentiinikoe kahjustuse arenemise kiirus erineb indiviiditi ja populatsiooniti.[17]
Mittekarioossed kahjustused
[muuda | muuda lähteteksti]Hammaste mittekarioossed kahjustused on multifaktoriaalsed protsessid, mida põhjustavad peamiselt keemilised ja mehaanilised tegurid[16].
Hammaste kõvakudede kahjustuste liigitus on järgmine:
- atritsioon – hambakudede kaotus hammaste omavaheliste kontaktide või parafunktsionaalse mälusaktiivsuse tõttu;
- abrasioon – hambakudede patoloogiline kulumine biomehaanilisest hõõrdumisest tingituna, näiteks hambaharjaga;
- erosioon – organismisisese või dieediga seotud happelise keskkonna põhjustatud hambakudede kaotus.;
- abfraktsioon – patoloogiline hambakudede kahjustus, mis tekib düsfunktsioonist tingitud mälumisjõudude toimel hammaste omavahelisest väändumisest[18].
Emaili arenguhäired
[muuda | muuda lähteteksti]Emailidefektid kujunevad välja vigase või vähese emaili formeerumise tõttu nii piima- kui ka jäävhammastel[19]. Arengulised emailidefektid võivad olla tingitud emaili valke kodeerivate geenide mutatsioonidest või olla üheks sündroomi ilminguks. Need süsteemsed haigused on eriti seotud kudedega, millel on sarnane embrüoloogiline päritolu. Emaili arenguhäireid põhjustavad ka keskkonna mõjutused ja süsteemsed seisundid nagu infektsioonid, metaboolsed haigused, ravimid, kemikaalid ning ka radiatsioon ja trauma[20].
Emailidefektid tekivad, kui esinevad häired emaili maatriksi formeerumisel või kaltsifitseerumise protsessis. Emaili maatriksi tekke häirete korral kujuneb välja hüpoplaasia, mis on kvantitatiivne defekt. Kliiniliselt avaldub hüpoplaasia õhenenud ja ebatasase emailikihina. Häired kaltsifiteerumise protsessis põhjustavad kvalitatiivse defekti, mida nimetatakse hüpomineralisatsiooniks. Hüpomineralisatisooniga hambad on opaaksed, poorsed ja kergesti purunevad[21][22].
Viited
[muuda | muuda lähteteksti]- ↑ Ten Cate AR. Oral Histology. 3rd Ed,. Lk 213.
- ↑ Zheng Q, Xu H, Song F, Zhang L, Zhou X, Shao Y, Huang D. Spatial distribution of the human enamel fracture toughness with aging. Journal of the mechanical behaviour of biomedical materials. 26(2013)
- ↑ Chai H, Lee JJ-W, Constantino PJ, Lucas PW, Lawn BR. Remarkable resiliance of teeth. Proc Natl Acad Sci USA. (2009);106(18):7289–7293.
- ↑ 4,0 4,1 Heymann HO, Swift Jr. EJ, Ritter AV. Sturdevant’s Art and Science of Operative Dentistry. 5th Ed. Lk 18–19.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ 5,0 5,1 5,2 5,3 5,4 Ross MH, Pawlina W. (2003). Histology: A text and atlas. 6th Ed. Lk 534–539.
- ↑ Nienstedt W, Hänninen O, Arstila A, Björkqvist SE (1999). Inimese füsioloogia ja anatoomia. Lk 299–300.
{{raamatuviide}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ 7,0 7,1 7,2 Avery JK (2002). Oral development and histology. 3rd Ed. Lk 156–157.
- ↑ Zeitz C, Faidt T, Grandthyll S, Hähl H, Thewes N et al. Synthesis of Hydroxyapatite Substrates: Bridging the Gap between Model Surfaces and Enamel. CS Appl. Mater. Interfaces (2016), 8 (39), 25848–25855
- ↑ Guo J, Lyaruu DM, Takano Y, Gibson CW, DenBesten PK, Bronckers ALJJ. Amelogenins as potential buffers during secretory-stage amelogenesis. (2015) Journal of Dental Research. Vol. 94(3): 412–420.
- ↑ 10,0 10,1 10,2 10,3 Moradian-Oldak J. Protein-mediated enamel mineralization. (2012) Frontiers in Bioscience, 17(7), 1996–2023
- ↑ Bronckers ALJJ. Ion transport by ameloblasts during amelogenesis. (2017) Journal of Dental Research.Vol. 96(3):243–253
- ↑ 12,0 12,1 12,2 Simmer JP, Richardson AM, Hu YY, Smith CE, Hu, JCC. A post-classical theory of enamel biomineralization...and why we need one. (2012). International Journal of Oral Science. 4(3):129–134
- ↑ 13,0 13,1 Simmer JP, Hu J.CC. Dental enamel formation and its impact on clinical dentistry. (2001). Journal of Dental Education. 65(9):896–905
- ↑ Lacruz RS, Habelitz S, Wright JT, Paine ML. Dental enamel formation and implications for oral health and disease. (2017) Physiological reviews 97(3):939–993
- ↑ Perez VA, Mangum JE, Hubbard MJ. Direct evidence that KLK4 is a hydroxyapatite-binding protein. (2017) Biochemical and Biophysical Research Communications. 495(2), 1896–1900
- ↑ 16,0 16,1 16,2 West NX, Joiner A. Enamel mineral loss. (2014) Journal of Dentistry. 42, S2-S11
- ↑ Cury JA, Tenuta LMA. Enamel remineralization: controlling the caries disease or treating early caries lesions? (2007) Brazilian Oral Reasearch. 23, 1:23–30.
- ↑ López-Frias FJ, Castellanos-Cosano L, Martin-Gonzáles J, Llamas-Carreras JM, Segura-Egea JJ. Clinical measurment of tooth wear: Tooth wear indices. (2012) Journal of Clinical and Experimental Dentistry. 4(1):48–53
- ↑ Kobayashi TY, Vitor LLR, Carrara CFC, Silva TC, Rios D, Machado MAAM, Oliviera TM. Dental enamel defect diagnosis through different technology-based devices. (2017) International Dental Journal, 68(3), 138–143.
- ↑ Seow WK. Developmental Defect of enamel and dentine: challenges for basic science research and clinical management. (2014) Australian Dental Journal. 59 Suppl 1:143-54
- ↑ Costa FS, Silveira ER, Pinto GS, Nascimento GG, Thomson WM, Demarco FF. Developmental defects of enamel and dental caries in primary dentition: A systematic review and meta-analysis.(2017) Journal of Dentistry, 60, 1–7.
- ↑ Silva MJ, Scurrah KJ, Craig JM, Manton DJ, Kilpatrick N. Etiology of molar incisor hypomineralization – A sistematic review. (2016) Community Dentistry and Oral Epidemiology, 44(4), 342–353.
