Siirdeseisund: erinevus redaktsioonide vahel
Eemaldatud sisu Lisatud sisu
PResümee puudub |
PResümee puudub |
||
| 6. rida: | 6. rida: | ||
Näide on kõrvaloleval skeemil: [[bromoetaan]]i [[SN2 reaktsioon|S<sub>N</sub>2 reaktsioon]] [[hüdroksiidioon]]iga; kandilistes sulgudes on kujutatud selle protsessi siirdeseisund. |
Näide on kõrvaloleval skeemil: [[bromoetaan]]i [[SN2 reaktsioon|S<sub>N</sub>2 reaktsioon]] [[hüdroksiidioon]]iga; kandilistes sulgudes on kujutatud selle protsessi siirdeseisund. |
||
Märkus. Siirdeseisund on põhimõtteliselt erinev [[intermediaat|intermediaadist]]: esimest iseloomustab [[reaktsioonikoordinaat|reaktsioonikoordinaadil]] [[energia]] maksimum, teist mõningane energia miinimum. |
Märkus. ''Siirdeseisund on põhimõtteliselt erinev [[intermediaat|intermediaadist]]: esimest iseloomustab [[reaktsioonikoordinaat|reaktsioonikoordinaadil]] [[energia]] maksimum, teist mõningane energia miinimum''. |
||
==Vaata ka== |
==Vaata ka== |
||
Redaktsioon: 19. veebruar 2015, kell 13:23
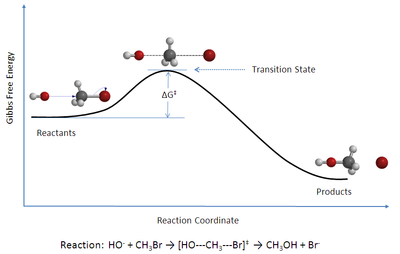

Siirdeseisund ehk siirdeolek on keemilises reaktsioonis reageerivate ainete aatomitevaheliste sidemete ja konfiguratsiooni teatud ümberkujunemine piki reaktsioonikoordinaati. See on lähteainete produktideks üleminekuseisund ja vastab süsteemi kõrgeimale energiale reaktsioonikoordinaadil, seega on tegu energeetilise barjääri ületamise momendiga.
Näide on kõrvaloleval skeemil: bromoetaani SN2 reaktsioon hüdroksiidiooniga; kandilistes sulgudes on kujutatud selle protsessi siirdeseisund.
Märkus. Siirdeseisund on põhimõtteliselt erinev intermediaadist: esimest iseloomustab reaktsioonikoordinaadil energia maksimum, teist mõningane energia miinimum.
