Ligandi sidumiskatse
Ligandi sidumiskatse on katse või analüütiline protseduur, mis põhineb ligandimolekulide seostumisel antikehade, retseptorite ja muude makromolekulidega.[1] Ligand-retseptor komplekside olemasolu ja ulatust detekteeritakse erinevate meetoditega, näiteks elektrokeemiliselt või fluorestsentsdetektsiooni abil.[2] Seda protseduuri on võimalik kasutada huvipakkuvate retseptorspetsiifiliste molekulide olemasolu kinnitamiseks proovis.[3]
On mitut tüüpi ligandi sidumiskatseid, nii radioaktiivseid kui ka mitteradioaktiivseid.[4][5][6] Kuigi radioligandi sidumiskatsed on kiired, lihtsasti kasutatavad ja reprodutseeritavad, on nad samal ajal ka ohtlikud inimese tervisele, tekitavad radioaktiivseid jääke, vajavad väga spetsiifilisi laboritingimusi ning on üldiselt üsna kallid. Need probleemid on viinud mitteradioaktiivsete sidumiskatsete arenduseni. Üldiselt baseeruvad mitteradioaktiivsed sidumiskatsed optilistel meetoditel nagu fluorestsentskiirguse polarisatsioon, fluorestsentskiirguse resonantsenergia ülekanne (FRET) ja pinnaplasmonite resonants. On olemas ka uuemat tüüpi "sega-ja-mõõda" sidumiskatsed, mida kasutatakse suure tootlikkusega sõeluuringutes (HTS). Nende puhul ei ole vaja eraldada seostunud ligandit seostumata ligandist.[5]
Kõige rohkem kasutatakse ligandi sidumiskatseid farmakoloogias. Sidumiskatsete abil loovad farmakoloogid ravimeid, mis on selektiivsed või käituvad sarnaselt endogeensete rakukomponentidega. Teisalt on olemas ka selliseid meetodeid, mille abiga luuakse retseptorite antagoniste ehk ligandeid, mis peatavad edasise signaalideraja.[7] Kõige sellega arvestades on teadlastel võimsad vahendid, millega mitte ainult kvantiseerida signaalmolekule ja nende retseptoreid, vaid ka panustada väärtusliku farmakoloogilise infoga ravimiarendusse ja raviplaanidesse.[8]
Ajalugu[muuda | muuda lähteteksti]
Ligandi sidumiskatsete teerajajaks võib pidada Karl Landsteinerit. Ta töötas loomade immuniseerimise alal, tootes kindlatele valkudele vastavaid antikehasid. Tänu Landsteineri tööle ja immunoanalüüsi tehnoloogiale, said teadlased hakata analüüsima molekulaarsel tasemel. 1960. aastal viisid Rosalyn Sussman Yalow ja Solomon Berson läbi esimese reaalse ligandi sidumiskatse. Nad uurisid insuliini ja temale spetsiifilise antikeha seostumist. Lisaks sellele töötasid nad välja esimese radioimmunoanalüüsi (RIA) insuliini jaoks. Nende avastused andsid väärtuslikku infot valguliste hormoonide tundlikkuse ja spetsiifika kohta verel baseeruvates vedelikes. 1977. aastal tunnustati Yalowi ja Bersoni saavutusi Nobeli auhinnaga meditsiinis. Teadlased on tänu RIA tehnoloogia väljatöötamisele suutnud radioaktiivsuse kasutamisest edasi liikuda ja sooritada katseid muude meetoditega.[9]
Kasutusalad[muuda | muuda lähteteksti]
Ligandi sidumiskatsetega saame teada, millised interaktsioonid kahe molekuli vahel tekivad ja mis on seostumise afiinsus. Sidumiskatsete kõige tähtsamad parameetrid on reagentide ja produktide kontsentratsioon, reaktsiooni tasakaalukonstandi stabiilsus kogu katse vältel ning kõrvalreaktsioonide usaldusväärsus ja kehtivus.[10] Olgugi et sidumiskatsed on üsna lihtsad, ei anna nad infot selle kohta, kas kasutatav ühend mõjutab enda sihtmärgiks oleva struktuuri talitlust.[11]
Radioligandi sidumiskatsed[muuda | muuda lähteteksti]
Radioligande kasutatakse, et mõõta ja määrata ligandi seostumist retseptoritega. Ideaalis peaks neil liganditel olema suur afiinsus, väike mittespetsiifiline seostumine, suur spetsiifiline aktiivsus väikeste retseptori kontsentratsioonide detekteerimiseks ja suur spetsiifiline seostumine.[7]
Radioligandi radioaktiivsuse tase (mooli kohta) väljendub spetsiifilise aktiivsusena (SA), mida mõõdetakse Ci/mmol. Radioligandi tegelik kontsentratsioon mõõdetakse tootjalt saadud ligandi stocklahust[küsitav] kasutades. Järgneva võrrandi abil saab algse kontsentratsiooni välja arvutada.[12]
Küllastussidumiskatsed[muuda | muuda lähteteksti]
Küllastussidumiskatsetel põhinevat analüüsi kasutatakse eri tüüpi kudede puhul, näiteks homogeniseeritud koed, millest võetakse osaliselt puhastatud plasma fraktsioone. Lisaks kudedele analüüsitakse rakke, mis toodavad kloonitud retseptoreid, ja ka rakke, mis on enne analüüsi kultuuris või isoleeritud. Küllastussidumiskatsetega saab määrata retseptori afiinsuse ja tiheduse. Uute ligandite kontsentratsioon, mida sidumiskatseks valida, tuleb määrata empiiriliselt.[7]
Sellise katse jaoks on kasutusel kaks strateegiat. Esimene võimalus on suurendada lisatud radioligandi kogust ning samal ajal hoida spetsiifiline aktiivsus ja radioligandi kontsentratsioon konstantsena. Teine võimalus on suurendada lisatud radioligandi kogust ning samal ajal märgistamata ligandi lisamise teel vähendada radioligandi spetsiifilist aktiivsust.[7]
Scatchardi graafik[muuda | muuda lähteteksti]
Scatchardi graafikuga näidatakse tavaliselt radioligandi afiinsust. Siin on näide Scatchardi graafikust:

Graafikul on y-teljel seotud/seostumata radioligandi kontsentratsioonide suhe ja x-teljel on seostunud radioligandi kontsentratsioon. Graafiku tõus on võrdne miinus ühe ja afiinsuskonstandi vahelise jagatisega. Punktis, kus graafik lõikab x-telge, asub maksimaalne sidumissaitide arv Bmax. Selleks, et võrrelda retseptori tihedusi erinevates kudedes ja katsetes, peab Scatchardi graafikut standardiseerima sobiva referentsprooviga. Siin graafikul on näha, et radioligand seostub kindla afiinsusega. Olukord võib olla ka selline, et ligand seostub mitmele retseptorile erineva afiinsusega. Sellisel juhul on graafik kumera joonega.[7]
Mittelineaarse kõvera sobitusprogrammid[muuda | muuda lähteteksti]
Mittelineaarse kõvera sobitusprogramme kasutatakse, et küllastus- ja konkurentse seostumise eksperimentide põhjal välja arvutada seostumise parameetreid. Selliste programmide alla kuuluvad Equilibrium Binding Data Analysis (EBDA) ja LIGAND. Esmane analüüs toimub EBDA abil. EBDA teisendab mõõdetud radioaktiivsuse molaarseks kontsentratsiooniks ja loob info põhjal Hilli tõusud ja Scatchardi transformatsioonid. EBDA-ga saadud infot saab kasutada LIGAND-is, et luua ligikaudne seostumise mudel.[13]
Konkurentne sidumine[muuda | muuda lähteteksti]
Konkurentset sidumist kasutatakse, et määrata ligandi spetsiifilisust retseptori alamtüüpidele. Selle abil leitakse iga alamtüübi tihedus ja proportsioon koes. Konkurentse sidumise kõveratel on ühel teljel spetsiifiline seostumine (protsentuaalselt totaalsest seostumisest) ja teisel logaritm konkurentse ligandi kontsentratsioonist. Järsk kõver viitab tavaliselt ühe populatsiooni retseptorite seostumisele.[7] Lauge või murdepunktidega kõver viitab aga mitmete sidumissaitide populatsioonidele.[13]
Mitteradioaktiivse ligandi sidumiskatsed[muuda | muuda lähteteksti]
Kuigi mitteradioaktiivsed sidumiskatsed on tehniliselt hoopis teistsugused, peavad nendes kasutatavad ligandid omama sarnaseid seostumise omadusi enda radioaktiivsetele ekvivalentidele. Tänu sellele on tulemused nii mitteradioaktiivsetes kui ka radioaktiivsetes katsetes omavahel kooskõlas. Nende kahe sidumiskatse suurimaks erinevuseks on oht inimese tervisele. Radioaktiivsed katsed on ohtlikud, kuna nende käigus tekib radioaktiivseid jäätmeid. Mitteradioaktiivse ligandi sidumiskatsetes on kasutusel aga sellised meetodid, millega toksilisi jäätmeid ei kaasne. Nende meetodite alla kuuluvad fluorestsentskiirguse polarisatsioon (FP), fluorestsentskiirguse resonantsenergia ülekanne (FRET), pinnaplasmonite resonants (SPR). Enamiku mitteradioaktiivsete meetodite puhul on tähtis, et ligandi märgistamine ei mõjutaks molekulaarseid interaktsioone. Vastasel juhul ei saaks mõõta ligandi ja retseptori seostumist.[5]
Fluorestsentkiirguse polarisatsioon (FP)[muuda | muuda lähteteksti]
Fluorestsentskiirguse polarisatsioon on sünonüümne fluorestsentsi anisotroopiaga. Selle meetodiga mõõdetakse fluorestsentsligandi roteerumise kiiruse muutust, kui toimub seostumine retseptorile. Ligand ergastatakse polariseeritud valgust kasutades ning mõõdetakse kiiratava valguse hulka. Kiiratava valguse depolarisatsioon sõltub ligandi suurusest. Väikese ligandi puhul on depolarisatsioon suur, mis tähendab, et valgust pööratakse väga kiirelt. Suurema ligandi puhul on depolarisatsioon väiksem. Selle meetodi eelis on ainult ühe märgistamise etapi vajalikkus. Sellegipoolest ei pruugi tulemused olla nii täpsed, kui seda meetodit kasutada nanomolaarsete või väiksemate kontsentratsioonidega.[5]
Fluorestsentkiirguse resonantsenergia ülekanne (FRET)[muuda | muuda lähteteksti]

FRET põhineb kahe üksteisele väga lähedal oleva molekuli vahelisel energia ülekandel. Sarnaselt FP-ga kasutatakse FRET-is fluorestsentsmärgisega ligandit. Kõigepealt ergastatakse doonormolekul. Energia ülekanne toimub doonori ja aktseptori vahelise dipool-dipool sideme kaudu. Aktseptor kiirgab doonorilt saadud energiat, siis kui ligand on kinnitunud retseptor-antikeha kompleksile. FRET-i toimumiseks ei tohi doonor- ja aktseptormolekulide vaheline kaugus olla suurem kui 10 nm ning ligandi sidumissait ei tohi olla blokeeritud. Oluline on ka see, et doonori fluorestsentkiirguse spekter kattuks aktseptori neeldumisspektriga.[5]
Pinnaplasmonite resonants (SPR)[muuda | muuda lähteteksti]
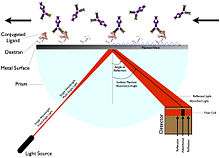
SPR-i puhul pole ligandit vaja märgistada. Pinnale suunatakse polariseeritud valgust ning mõõdetakse peegeldumisnurga muutust. Peegeldumisnurk on otseselt seotud pinnakihi paksuse ja tihedusega. Juhul kui pinnale on kinnitunud ligand, siis peegelduva valguse intensiivsus kasvab ning ka peegeldumisnurk muutub.[5]
Ligandi sidumiskatsed tahkel faasil[muuda | muuda lähteteksti]
Multiwelli plaadiga katsed[muuda | muuda lähteteksti]
Multiwelli plaadid on anumad, kuhu on paigutatud 6 kuni 1536 süvendit, mis on analoogsed petri tassiga. Paljud mõõteinstrumendid ja nende süsteemid on üles ehitatud Multiwelli plaatide lugemiseks.[14] Multiwelli-katsetes on mugav hoida koguseid kontrolli all ja teha proovidest replikaate. Plaatide põhja võib paigaldada elektroode, et sidumiskatsetest rohkem infot saada. Seostunud kompleksid kinnituvad elektroodidele, mille kaudu saab neid analüüsida.[9]
Multiwelli plaadid on teadlastele väga mugavad, sest erinevates süvendites on võimalik läbi viia erinevaid sidumiskatseid. Aeg-ajalt võib esineda tulemustes hälbeid, mis on tingitud sellest, et plaat ei ole tervenisti ühtlane. Erinevaid hälbeid põhjustavad süvendi, äärte ja plaadi efektid. Seega oluline on teha korrektne katse ülesehitus, mis kehtiks nii üksikplaadile kui ka mitmele katseplaadile.[14]
Filtriga sidumiskatsed[muuda | muuda lähteteksti]
Filtrit kasutatakse tahke faasi ligandi sidumiskatsetes, kus on vaja mõõta kahe seostuva molekuli vahelist afiinsust. Filtrid püüavad rakumembraanid kinni ning ülejäänud algse lahuse komponendid imetakse läbi filtrite. Filtreid pestakse puhvriga, mis eemaldab mitteseostunud ligandid. Alles jäävad konkreetse ligandi ja retseptori vahel moodustunud kompleksid. Filtri omadustest sõltub, kui suuri ja milliseid osakesi filtrile püüda saab, näiteks tihedama filtriga saab püüda väiksemaid membraani tükke. Lisaks töödeldakse filtri pindu ainetega, mis annavad pinnale positiivse laengu, et negatiivselt laetud membraani osad paremini kinnituks.[8]
Seostumise spetsiifika[muuda | muuda lähteteksti]
Ravimainete mõju sõltub nende seostumise selektiivsusest ja sellest, millise afiinsusega need substraadile kinnituvad. Ligandi selektiivsus temale vastava retseptori suhtes annab teadlastele võimalusi luua spetsiifilisi ravimite efekte. Selleks tuleb opereerida ligandi kontsentratsioonide ja retseptori tihedusega. Hormoone ja neurotransmittereid võib pidada kõige tähtsamateks füsioloogiliste retseptorite reguleerijateks organismis. Nendele retseptoritele mõeldud ravimid on väga selektiivsed, et kutsuda esile vajalikke signaalmolekulide vastuseid.[15]
Ligandi seostumist temale vastava retseptoriga nimetatakse spetsiifiliseks seostumiseks ning spetsiifilisi sidumissaite võib olla mitmeid. Mittespetsiifiline seostumine on ligandi kinnitumine mingile muule objektile kui temale vastav retseptor, näiteks teist tüüpi retseptoritele või membraanil olevatele ainete transporteritele. Muskariinsed antagonistid võivad näiteks histamiini retseptoritele kinnituda. Sellist seostumist võib pidada spetsiifiliseks, sest ligand on mitme retseptori jaoks spetsiifiline. Ehkki teiste seostumise omadustega võrreldes ei kuulu see teadlaste huviorbiiti, on mittespetsiifiline seostumine siiski väga oluline ja informatiivne. Üldiselt mõõdetakse mittespetsiifikat antagonisti kasutades, mis seostub ligandiga samale retseptorile. Antagonist blokeerib ligandi spetsiifilise seostumise ning ülejäänud seostumine on mittespetsiifiline.[16]
| Imiteerivad endogeenseid efekte | Inhibeerivad endogeenseid efekte |
|---|---|
| Agonist | Antagonist |
| Pool-agonist | Pöörduv-antagonist |
Piirangud[muuda | muuda lähteteksti]
Ligandi sidumiskatseid teostatakse kontrollitud keskkonnas in vitro ehk see ei anna infot sellest, kuidas sama protsess toimub in vivo. Tulemuste põhjal saab kinnitada ligandi sobivust retseptorile, ent pole antud infot vastava retseptori jagunemisest kehas.[13]
Viited[muuda | muuda lähteteksti]
- ↑ Luckey, J.; et al. (1993). "[12] High-speed DNA sequencing by capillary gel electrophoresis". Methods in Enzymology. 218 (12): 154–172.
- ↑ Ninfa; et al. (2010). Fundamental Laboratory Approaches for Biochemistry and Biotechnology. Dearborn, MI: University of Michigan.
- ↑ Mullis, K.B; Faloona, F.L. (1987). "[21] Specific synthesis of DNA in vitro via a polymerase-catalyzed chain reaction". Methods in Enzymology. 155 (21): 335–350.
- ↑ Sittampalam, G. S.; Kahl, S. D.; Janzen, W. P. (1997). "High-throughput screening: Advances in assay technologies". Current Opinion in Chemical Biology. 1 (3): 384–391.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 De Jong, L. A. A.; Uges, D. R. A.; Franke, J. P.; Bischoff, R. (2005). "Receptor–ligand binding assays: Technologies and Applications". Journal of Chromatography B. 829 (1–2): 1–25.
- ↑ Joseph R. Lakowicz. (1991) Topics in Fluorescence Spectroscopy: Biochemical applications.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 Anthony P. Davenport; Fraser D. Russel (1996). "Radioligand Binding Assays: Theory and Practice". In Stephen J. Mather. Current directions in radiopharmaceutical research and development. Springer Netherlands. pp. 169–179.
- ↑ 8,0 8,1 Hulme, Edward C.; Trevethick, Mike A. (November 2010). "Ligand binding assays at equilibrium: validation and interpretation". British Journal of Pharmacology. 161 (6): 1219–1237.
- ↑ 9,0 9,1 Masood N. Khan; John W. Findlay, eds. (2009). Ligand-binding assays development, validation, and implementation in the drug development arena. Hoboken, N.J.: John Wiley & Sons.
- ↑ POLLARD, Thomas D. (1 December 2010). "A Guide to Simple and Informative Binding Assays". Molecular Biology of the Cell. 21: 4061–4067.
- ↑ Offermanns, Stefan; (eds.), Walter Rosenthal (2008). Encyclopedia of molecular pharmacology (2nd ed.). Berlin: Springer. p. 585.
- ↑ 12,0 12,1 Kahl, Steven D.; G. Sitta Sittampalam; Jeffrey Weidner (1 May 2012). "Calculations and Instrumentation used for Radioligand Binding Assays". Assay Guidance Manual: 1–21.
- ↑ 13,0 13,1 13,2 Davenport, Anthony P. (2005). Receptor Binding Techniques. Humana Press. pp. 18–19,101–102,121–122,203–204.
- ↑ 14,0 14,1 Robinson, C. Jane; Michael Sadick; Stanley N. Deming; Sian Estdale; Svetlana Bergelson; Laureen Little (January 2014). "Assay Acceptance Criteria for Multiwell-Plate–Based Biological Potency Assays". BioProcess International. 12 (1): 30–41.
- ↑ Goodman & Gilman's The Pharmacological Basis of Therapeutics. The McGraw Hill Companies Inc. 1996. pp. 29–37.
- ↑ Foreman, J. C.; Torben Johansen (2003). "5". Textbook of Receptor Pharmacology (Second ed.). Boca Raton, Florida: CRC L.L.C. pp. 153–180.

