Sadestamine (keemia): erinevus redaktsioonide vahel
Resümee puudub |
PResümee puudub |
||
| 4. rida: | 4. rida: | ||
Sademe moodustumine tuleneb aine [[lahustuvus]]est, mida mõjutavad ka [[temperatuur]] ja [[rõhk]]. Sadenemine saab toimuda, kui aine [[kontsentratsioon]] [[lahus]]es ületab lahustuvuse. Kiiresti toimub see [[üleküllastunud lahus]]est. |
Sademe moodustumine tuleneb aine [[lahustuvus]]est, mida mõjutavad ka [[temperatuur]] ja [[rõhk]]. Sadenemine saab toimuda, kui aine [[kontsentratsioon]] [[lahus]]es ületab lahustuvuse. Kiiresti toimub see [[üleküllastunud lahus]]est. |
||
Sadestamisel lisatakse lahusele [[gaas]]ilist, [[vedelik|vedelat]] või [[tahkis|tahket]] [[reaktiiv]]i |
Sadestamisel lisatakse lahusele [[gaas]]ilist, [[vedelik|vedelat]] või [[tahkis|tahket]] [[reaktiiv]]i – sadestit, mis moodustab eraldatava komponendiga/komponentidega raskesti lahustuva ühendi. Sadestusmeetodit kasutatakse [[analüütiline keemia|keemilise mahtanalüüsi]] meetodina ja ainete [[lahutusmeetodid|lahutamiseks]]. Sadenemise saab esile kutsuda ka nn antisolvendi (see on [[solvent]], milles reaktsiooniprodukt on lahustumatu, näiteks [[etanool]]i lisamine vesilahusele) lisamisega. |
||
Klassikaline '''sadestusreaktsioon''' on [[hõbekloriid|AgCl]] sademe (s = ''solid'' = tahke) teke [[hõbenitraat|AgNO<sub>3</sub>]] vesilahusele [[kaaliumkloriid|KCl]] lisamisel (aq = ''aqueous solution'' = vesilahuses): |
Klassikaline '''sadestusreaktsioon''' on [[hõbekloriid|AgCl]] sademe (s = ''solid'' = tahke) teke [[hõbenitraat|AgNO<sub>3</sub>]] vesilahusele [[kaaliumkloriid|KCl]] lisamisel (aq = ''aqueous solution'' = vesilahuses): |
||
Redaktsioon: 16. veebruar 2015, kell 17:38
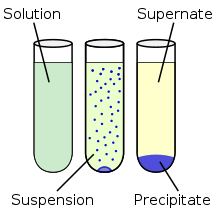
Keemias tähendab sadestamine või sadenemine lahuses tahke faasi (sademe) moodustumist keemilise reaktsiooni tagajärjel. Aine sadenemine toimub, kui keemilises reaktsioonis tekib lahustumatu või vähelahustuv aine.
Sademe moodustumine tuleneb aine lahustuvusest, mida mõjutavad ka temperatuur ja rõhk. Sadenemine saab toimuda, kui aine kontsentratsioon lahuses ületab lahustuvuse. Kiiresti toimub see üleküllastunud lahusest.
Sadestamisel lisatakse lahusele gaasilist, vedelat või tahket reaktiivi – sadestit, mis moodustab eraldatava komponendiga/komponentidega raskesti lahustuva ühendi. Sadestusmeetodit kasutatakse keemilise mahtanalüüsi meetodina ja ainete lahutamiseks. Sadenemise saab esile kutsuda ka nn antisolvendi (see on solvent, milles reaktsiooniprodukt on lahustumatu, näiteks etanooli lisamine vesilahusele) lisamisega.
Klassikaline sadestusreaktsioon on AgCl sademe (s = solid = tahke) teke AgNO3 vesilahusele KCl lisamisel (aq = aqueous solution = vesilahuses):
- AgNO3 (aq) + KCl (aq) → AgCl (s) + KNO3 (aq)
Kui sademes on osakesed vähe liitunud ja kerged, siis jäävad need hõljuma suspensioonina.
Sade eraldatakse lahusest setitamise ja dekanteerimisega, filtrimisel või tsentrifuugimisel.
