Sadestamine (keemia): erinevus redaktsioonide vahel
Resümee puudub |
Resümee puudub |
||
| 16. rida: | 16. rida: | ||
[[Kategooria:Keemilised reaktsioonid]] |
[[Kategooria:Keemilised reaktsioonid]] |
||
[[Kategooria:Labor]] |
|||
[[ca:Precipitació química]] |
[[ca:Precipitació química]] |
||
Redaktsioon: 5. veebruar 2013, kell 15:19
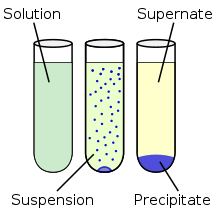
Keemias tähendab sadestamine lahuses tahke faasi (sademe) moodustumist keemilise reaktsiooni tagajärjel. Aine sadestamine toimub, kui keemilises reaktsioonis tekib lahustumatu või vähelahustuv aine.
Sademe moodustumine tuleneb aine lahustuvusest, mida mõjutavad ka temperatuur ja rõhk. Sadestumine saab toimuda, kui aine kontsentratsioon lahuses ületab lahustuvuse. Kiiresti toimub see üleküllastunud lahusest. Sadestumise saab esile kutsuda ka nn. antisolvendi (see on solvent, milles reaktsiooniprodukt on lahustumatu) lisamine.
Klassikaline sadestamisreaktsioon on AgCl sademe (s = solid = tahke) teke AgNO3 vesilahusele KCl lisamisel (aq = aqueous solution = vesilahuses):
- AgNO3 (aq) + KCl (aq) → AgCl (s) + KNO3 (aq)
Kui sademes on osakesed vähe liitunud ja kerged, siis jäävad need hõljuma suspensioonina.
Sade eraldatakse lahusest dekanteerimisega, filtrimisega või tsentrifuugimisel.
