Peptiidisüntees
See artikkel ootab keeletoimetamist. |
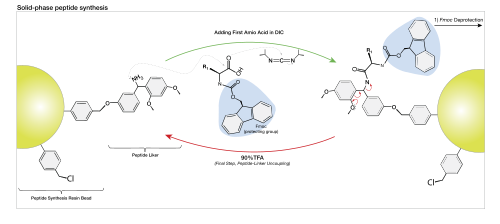
Peptiidisüntees on orgaanilise keemia alla kuuluv orgaanilise sünteesi liik, mida kasutatakse peptiidide sünteesiks.
Peptiidid on aminohapetest koosnevad orgaanilised ühendid, kus aminohapped on omavahel ühendatud amiidsidemetega (peptiidside). Biokeemilist protsessi, mille käigus sünteesitakse pikki peptiide ehk proteiine, nimetatakse proteiinide ehk valkude biosünteesiks, selle protsessi tehislikku analoogi aga peptiidisünteesiks.
Peptiidi sünteesimiseks seotakse ühe aminohappe karboksüülrühm (C-ots) teise aminohappe aminorühma külge (N-ots). Võimalike kõrvalreaktsioonide vältimiseks kasutatakse kaitserühmi. Keemiline peptiidisüntees algab peptiidi C-otsast ja lõppeb N-otsas. See on vastupidine valkude biosünteesile, mis toimub alates N-otsast suunaga C-otsa poole.
Eristatakse vedelfaasi peptiidisünteesi ja tahke faasi peptiidisünteesi. Nüüdisajal kasutatakse laborites peamiselt tahke faasi põhist lahendust.
Vedelfaasi peptiidisüntees[muuda | muuda lähteteksti]
Vedelfaasi peptiidisüntees on klassikaline viis peptiidi saamiseks, kuid tänapäeval on see enamikus laborites asendatud tahkel kandjal sünteesiga. Sellegipoolest on lahuses sünteesimisel ka omad positiivsed küljed. Nii saab näiteks sünteesida väga suurtes kogustes, mis on määrav tööstuslikus mahus peptiidide ning proteiinide tootmisel.
Tahke faasi peptiidisüntees[muuda | muuda lähteteksti]

Tahke faasi süntees, mille töötas välja Robert Bruce Merrifield[1], tõi uued tuuled peptiidisünteesi valdkonda. Tänapäeval on see ülemaailmselt tunnustatud viis peptiidide ja proteiinide saamiseks laboris. Tahkel kandjal sünteesimine annab võimaluse produtseerida selliseid looduslikke peptiide, mida on väga raske bakterite abil toota. Teised võimalikud väljundid on
- tehisaminohapete kasutamine,
- peptiidi/proteiini külgahelate modifitseerimine
- D-aminohapete kasutamine D-proteiinide saamiseks.
Tahkeks kandjaks on väikesed lahustumatud poorsed vaiguterad, mis on töödeldud funktsionaalsete vahelülidega. Vajaliku põhiahela valmimisel lõigatakse peptiid vaigu küljest. Selleks kasutatakse mõnda tugevamat hapet, nagu veevaba vesinikfluoriidhapet või trifluoroatseethapet, ning seejärel ekstraheeritakse peptiid lahusest.
Tahkel kandjal peptiidisünteesi põhimõte seisneb korduvas tsüklis, mis koosneb korduvatest etappidest: aminohappe sidumisest, üleliigsete reagentide välja pesemisest, ajutise kaitserühma maha võtmisest ning jälle pesust. Peptiidi süntees tahkel kandjal algab esimese aminohappe karboksüülrühma sidumisega tahkele kandjale (vaigule) läbi funktsionaalse vahelüli (linkeri), millel on vaba aminorühm. Tahke kandjaga seotud aminohappelt eemaldatakse N-otsa kaitserühm, andes vaba amiini, seejärel aktiveeritakse järgmise seotava aminohappe C-otsa karboksüülrühm ning need aminohapped seotakse omavahel. Selle meetodi eelis seisneb üleliigsete reagentide väljapesemises, mida tehakse iga läbiviidud reaktsiooni järel, jättes peptiidi vaiguga kovalentselt seotuks.
Väga tähtis on peptiidisünteesis saada pärast iga etappi võimalikult suur saagis, sest kaod teoreetilise saagise suhtes kasvavad iga sammuga. Näiteks, kui iga sidumise saagis oleks 99%, siis 26-aminohappelise peptiidijärjestuse puhul tuleks saagis 77% (eeldades, et kaitserühmade eemaldamised toimusid 100% saagisega). Kui iga sidumise saagis oleks 95%, siis oleks lõppsaagis juba 25%. Seepärast võetakse igat aminohapet arvestatavas ülehulgas (2–10 korda) ja sidumine on täpselt optimeeritud, kasutades selleks hästi karakteriseeritud reagente.
Tahke faasi peptiidisüntees jaguneb kaheks vastavalt kasutatavate aminohapete ajutisele kaitserühmale: Fmoc ja Boc sünteesistrateegiad. See tähendab, et aminohappe monomeeri N-ots on kaitstud vastavalt strateegiale Fmoc või Boc ajutise kaitserühmaga.
Automatiseeritud süntesaatorid on välja töötatud mõlema tehnika jaoks, kuigi paljud teadusrühmad sünteesivad peptiide endiselt käsitsi, sest süntesaatorid on võrdlemisi kallid.
Tahkel kandjal peptiidisüntees on limiteeritud saagistega. Sellest tulenevalt panevad peptiidid ja proteiinid, mille järjestuses on üle 70 aminohappe, selle meetodi proovile. Saagist võivad alandada ka rasked järjestused, näiteks amüloid peptiide ja valke on raske sünteesida. Nii pikkade järjestuste sünteesimiseks võib kasutada keemilise ühendamise meetodit, milleks käigus liidetakse omavahel kaks peptiidi.
Viimase 40 aasta jooksul on tahkel kandjal peptiidisünteesi optimeerimise juures nähtud palju vaeva. Esiteks on kandjat ehk vaiku ennast kõvasti arendatud; teiseks on vahelülid aminohappe C-otsa ehk karboküülrühma ja polüstüreenvaigu vahel paremini monomeeri külge seotavad, olles samas kergemini läbilõigatavad, andes kokkuvõteks suurema kvantitatiivse saagise. Aminohapete kõrvalahelate kaitserühmade areng on vähendanud ebavajalike kõrvalreaktsioonide toimumist. Peale selle on uute karboksüülrühma aktiveerimisreagentide välja töötamine parandanud aminohappe sidumist ning vähendanud tema epimerisatsiooni. Viimaseks on ratsionaliseeritud kogu protsessi ennast. Merrifieldi algses protokollis saadi α-amino kaitserühma eemaldamisel kandjal oleva peptiidi sool, mis vajas enne aminohappe sidumist neutraliseerimist alusega. Aeg, mis jäi kaitserühma eemaldamise ja aminohappe sidumise vahele, andis kandjal olevatele peptiidiahelatele võimaluse omavahel agregeeruda ning vähendas saagist. Kenti teadusrühm näitas, et α-aminorühma neutraliseerimine andis suurema saagise.[2] Kõik eelnevad täiustused on aidanud tahke faasi peptiidisünteesil saada lihtsasti õpitavaks ja hõlpsaks tehnikaks.
Tahked kandjad[muuda | muuda lähteteksti]
Termin "tahke kandja" jätab mulje, nagu reaktsioonid toimuks kandja pinnal, aga nii see tegelikult pole. Reaktsioonid toimuvad ka kandja sisemuses, niisiis termin "tahke kandja" kirjeldab pigem polümeeri lahustumatust. Nõuded tahkele kandjale:[3]
- peab olema füüsiliselt stabiilne ja võimaldama lahustel kiiresti polümeeri läbida;
- peab olema inertne kõigi reagentide ja solventide suhtes, mida kasutatakse sünteesi jooksul;
- peab laialdaselt paisuma solventides, et reagendid saaksid paremini tungida polümeeri sisemusse;
- peab võimaldama aminohappe sidumist.
Levinud on peamiselt nelja tüüpi tahked kandjad:[3]
- Geel-tüüpi kandjad: tugevasti solvateeritud polümeerid, mis on ühtlase funktsionaalsete rühmade jaotusega. Seda tüüpi kandjad on ühed kasutatumad ning jagunevad vastavalt koostisele:
- Polüstüreen: stüreen on ristseotud
- Polüakrüülamiid: hüdrofiilne alternatiiv polüstüreenile
- Polüetüleenglükool (PEG): PEG-Polüstüreen (PEG-PS) on stabiilsem kui polüstüreen ning jätab polümeeriahela ja sünteesi algpunkti vahel rohkem ruumi
- PEG-l baseeruvad kandjad: koosnevad PEG-polüpropüleenglükooli võrgustikust või PEG-st, mis on seotud polüamiidi või polüstüreeniga
- Pind-tüüpi kandjad: on olemas palju materjale, mis on arendatud materjali pinna funktsionaliseerimise eesmärgil, näiteks: poorne klaas, tsellulooskiud ning laialdaselt ristseotud polüstüreenid.
- Komposiitmaterjalid: geel-tüüpi polümeerid, mida seovad ranged maatriksid.
Polüstüreenkandja[muuda | muuda lähteteksti]

Polüstüreen on universaalne ja kasulik kandja materjal automatiseeritud peptiidisünteesis, tänu tema vähesel määral paisumisele diklorometaanis. Seda kandjat kasutas algselt oma töös ka R. Bruce Merrifield, tänu millele seda kutsutakse ka Merrifieldi kandjaks. Põhimõtteliselt on tegu hüdrofoobse kandjaga, mis on solvateeritud mittepolaarse solvendiga, näiteks diklorometaaniga.
Polüamiidkandja[muuda | muuda lähteteksti]
Polüamiidkandja on laia kasutusalaga kasulik materjal, mis paisub lahustis tunduvalt rohkem kui polüstüreen. See omadus piirab tema kasutust automatiseeritud süntesaatorites, kui nende reaktsiooninõud on liiga väikese ruumalaga.
PEG-polüstüreenkandja[muuda | muuda lähteteksti]
Selle alamtüübi üheks näiteks on Tentagel-kandja. Ehituslikult on tegemist polüstüreenkandjaga, millele on seotud pikad polüetüleenglükooli ahelad (Mw~3000Da). Süntees viiakse läbi PEG ahelate kaugemas otsas, mis annab pikemate ja keerulisemate peptiidide sünteesiks rohkem ruumi. See kandja ei paisu eriti sünteesi käigus, mis teeb ta paremini kasutatavaks masinaga sünteesil.
PEG-l baseeruvad kandjad[muuda | muuda lähteteksti]
ChemMatrix® on uut tüüpi kandja, mis baseerub ristseotud PEG-l. Selle kandja puhul on tegemist keemiliselt ja termiliselt väga stabiilse materjaliga, mis on väga suure paisumisvõimega sellistes lahustites, nagu atseetonitriil, diklorometaan, dimetüülformamiid, N-metüülpürrolidoon, trifluoroatseethape ning vesi. ChemMatrix on näidanud häid tulemusi hüdrofoobsete peptiidide sünteesil.
Kaitserühmad[muuda | muuda lähteteksti]
Kuna aminohapetel on reaktsioonivõimelise rühmad C-otsas, N-otsas kui ka osade aminohapete kõrvalahelate funktsionaalrühmadel, siis peab neid desaktiveerima, blokeerima, et nad soovimatult reaktsioonist osa ei võtaks ega vähendaks saagist ja selle puhtust. Selleks on loodud keemilised molekulid, mis spetsiifiliselt blokeerivad teatud tüüpi funktsionaalrühmi:
- N-otsa kaitserühmad
- C-otsa kaitserühmad
- Kõrvalahela kaitserühmad
N-otsa kaitserühmad[muuda | muuda lähteteksti]
Aminohapet kasutatakse sünteesil ülehulgas, vältimaks mittetäielikku sidumist. Ilma N-otsa kaitserühmata võib toimuda aminohappe polümerisatsioon, mis võib viia madala saagise või sünteesi katkemiseni. Selle kaitsrühma eemaldamine peptiidilt enne järgmise aminohappe sidumist toob sünteesi skeemi muudatuse. Tahke faasi peptiidisüntees jaguneb kahte rühma vastavalt kasutatavate aminohapete ajutisele kaitserühmale. Kasutatakse Fmoc/tBu ja Boc/Bzl sünteesistrateegiat, kus tBu ja Bzl tähistavad aminohapete kõrvalahelate kaitserühmi.[3]
t-Boc kaitserühm[muuda | muuda lähteteksti]

Selle meetodi puhul on tertbutüüloksükarbonüül või lihtsamalt t-Boc α-aminorühma nukleofiilsuse vähendamiseks sellega kovalentselt seotud. Boc rühm eemaldatakse N-otsast happega (nt TFA). Selle käigus saadakse positiivsel laetud aminorühm, mis neutraliseeritakse järgmise seotava aktiveeritud aminohappega.[2]
Fmoc kaitserühm[muuda | muuda lähteteksti]

Vesinikfluoriidi võime degradeerida peptiidkandjalt lõikamise käigus viis uue α-aminorühma kaitserühma – 9-fluoroenüülmetüüloksükarbonüül rühma (Fmoc) väljatöötamiseni. Selle meetodi puhul eemaldatakse Fmoc rühm N-otsast alusega(nt: piperidiin).[3] Peptiidi lõikamine kandjalt saab tänu sellele toimuda leebemates tingimustes (TFA-ga) kui Boc strateegia puhul(HF-ga). Alusega töötlemise käigus saadakse juba neutraalne N-ots. Kuna kandjal jäävad kõik N-otsad neutraalseks, siis puuduvad ahelatevahelised elektrostaatilised tõukumised, mis omakorda võib kaasa tuua ahelate omavahelise agregeerumise. See probleem Boc meetodi puhul puudub.
Boc-rühma võrdlus Fmoc-rühmaga tahke faasi peptiidisünteesi korral[muuda | muuda lähteteksti]
Nii Boc- kui ka Fmoc-rühma kasutamisel on positiivseid ja samas ka negatiivseid külgi. Seega tehakse kaitserühma valik üldjuhul juhtumipõhiselt.
| Parameeter | Boc | Fmoc |
|---|---|---|
| Spetsiaalse varustuse vajalikkus | Jah | Ei |
| Reagentide maksumus | Odavam | Kallim |
| Peptiidide lahustuvus | Suurem | Väiksem |
| Hüdrofoobsete peptiidide puhtus | Kõrge | Võib olla madalam |
| Agregatsiooniprobleemide esinemine | Harvemini | Tihedamalt |
| Sünteesi kestus | ~20 min aminohappe kohta | ~20–60 min aminohappe kohta |
| Vabastamine kandjalt | Vesinikfluoriidhape | Trifluoroetaanhape |
| Ohtlikkus | Potentsiaalselt ohtlik | Üsna ohutu |
| Ortogonaalsus | Ei | Jah |
Viited[muuda | muuda lähteteksti]
- ↑ R. B. Merrifield (1963). "Solid Phase Peptide Synthesis. I. The Synthesis of a Tetrapeptide". J. Am. Chem. Soc. 85 (14): 2149–2154. DOI:10.1021/ja00897a025.
- ↑ 2,0 2,1 Schnolzer, M. A., P.; Jones, A.; Alewood, D.; Kent, S.B.H. (2007). "In Situ Neutralization in Boc-chemistry Solid Phase Peptide Synthesis". Int. J. Peptide Res. Therap. 13 (1–2): 31–44. DOI:10.1007/s10989-006-9059-7.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ 3,0 3,1 3,2 3,3 Albericio, F. (2000). Solid-Phase Synthesis: A Practical Guide (1 ed.). Boca Raton: CRC Press. Lk 848. ISBN 0824703596.
