G-valgud


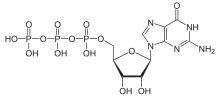
G-valgud ehk guaniininukleotiide siduvad valgud on valdavalt eukarüootsetel organismidel klassifitseeritud valkude perekond, mis tegeleb väljastpoolt rakku tulevate keemiliste signaalide ülekandega raku sisemusse. G-valgud kuuluvad ensüümiklasside nomenklatuuris suuremasse ensüümiklassi hüdrolaasid – GTP-aaside hulka.[1] G-valgud toimivad kui molekulaarsed lülitid. Nende aktiivsust reguleerivad teatud tegurid, mis määravad nende võime siduda ja hüdrolüüsida guanosiintrifosfaati (GTP) guanosiindifosfaadiks (GDP). Kui G-valgud seovad GTP-d, võib öelda, et nad on "sisse lülitatud", ja kui nad seovad GDP-d, siis on nad "välja lülitatud".
G-valgud võib jaotada kaheks: monomeersed väikesed GTP-aasid ja heterotrimeersed G-valgud. Viimane neist koosneb kolmest alaühikust: alfa (α), beeta (β) ja gamma (γ).[2] Beeta ja gamma alaühikud võivad moodustada püsiva dimeerse kompleksi, mida nimetatakse beeta-gamma kompleksiks.
G-valgud aktiveeruvad G-valguga seotud retseptorite (GPCR) kaudu, mis asuvad raku membraanil ja millele on omane seitsme transmembraanne (7Tm- retseptor) struktuur. Virgatsaine seostub retseptorile ja sellega kaasnev konformatsiooni muutus aktiveerib retseptoriga seotud G-valgu. G-valk omakorda aktiveerib arvukalt signaaliradasid, mille tulemusena tekib muutus raku talitluses.
G-valkudega seotud signaali ülekannet on võimelised ajendama mitmed hormoonid, virgatsained ja teised signaaliülekandega seotud tegurid.[3] G-valgud reguleerivad mitmeid rakus olevaid metaboolseid ensüüme, ioonkanaleid ja transportereid, mis omakorda mõjutavad funktsioone ja protsesse nagu näiteks loote areng, õppimisvõime ja mälu.[4]
Ajalugu[muuda | muuda lähteteksti]
G-valgud avastasid Alfred G. Gilman ja Martin Rodbell, kui nad uurisid adrenaliini mõju rakkudele. Nad avastasid, et kui adrenaliin seostub retseptorile, siis see retseptor ei ole ensüümide otsene stimulaator. Retseptor stimuleerib hoopis G-valku, mis omakorda stimuleerib ensüümi. Selle näiteks on ensüüm adenülaaditsüklaas (AC). Adrenaliini molekuli seostumisel retseptoriga aktiveerub retseptoriga seotud G-valk. See stimuleerib adenülaaditsüklaasi, mis hakkab tootma sekundaarset virgatsainet tsüklilist adenosiinmonofosfaati (cAMP). Selle avastuse eest said nad 1994. aastal Nobeli füsioloogia- või meditsiiniauhinna.
Funktsioon[muuda | muuda lähteteksti]
G-valgud on olulised signaaliülekandes osalevad molekulid rakus. Sellised haigused nagu diabeet, pimedus, allergiad, depressioon, südame-veresoonkonna haigused ja kindlad vähktõve vormid on seotud G-valkudega seotud retseptorite (GPCR) väärtalitlusega signaaliülekandes. Sellest tulenevalt on ligikaudu 40% tänapäeva ravimitest suunatud just GPCR-le.[5]
Inimgenoomi on kodeeritud ligikaudu 950 G-valguga seotud retseptorit, mis detekteerivad footoneid, hormoone, kasvufaktoreid, ravimeid ja muid endogenoosseid ligande. Otstarve on teadmata umbes sajaviiekümnel GPCR-l.
G-valkude signaaliülekande tüübid[muuda | muuda lähteteksti]
G-valgud võib jagada kahte rühma: heterotrimeersed ehk nn suured ja monomeersed ehk nn väiksed G-valgud. Heterotrimeerseid G-valke aktiveerivad GPCR-id ja need koosnevad alfa (α), beeta (β) ja gamma (γ) alaühikutest. Monomeersed G-valgud (20–25 kDa) kuuluvad väikeste GTP-aaside alla kuuluvasse Ras superperekonda. Monomeerne G-valk on homoloogiline heterotrimeerse G-valgu alfa alaühikuga. Ka monomeersed G-valgud seostuvad GTP ja GDP-ga ning osalevad signaaliülekandes.
Heterotrimeersed G-valgud[muuda | muuda lähteteksti]
Heterotrimeerseid G-valke on mitut tüüpi, kuid neil on kõigil sama tööpõhimõte. Kui ligand seostub G-valguga seotud retseptorile, siis kaasneb sellega retseptori konformatsiooni muutus. See aktiveerib heterotrimeerse G-valgu ja GDP vahetub GTP vastu. Seejärel G-valk eraldub retseptorist ja alfa alaühik eraldub beeta-gammakompleksist. Eraldunud alaühikud saavad nüüd aktiveerida järgmisi virgatsaineid signaaliülekanderajal. Spetsiifiline mehhanism on aga erinevatel heterotrimeetsete G-valkude tüüpidel erinev.
Üldine tööpõhimõte[muuda | muuda lähteteksti]
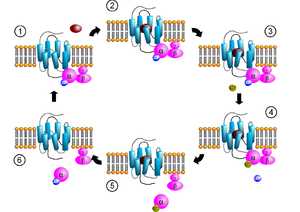
G-valgud on seotud raku membraani sisepinnaga. Need koosnevad Gα ja sellega tihedasti seotud Gβγ alaühikutest. Gα alaühikuid on mitut liiki: Gsα (aktiveeriv G-valk), Giα (inhibeeriv G-valk), Goα, Gg/11α ja G12/13α on vaid mõned näited. Neil on sama aktivatsioonimehhanism, kuid nad reageerivad erinevate ligandide puhul erinevalt.
Aktivatsioon[muuda | muuda lähteteksti]
Ligand, seostudes G-valguga seotud retseptorile, tekitab retseptoris konformatsiooni muutuse. Seetõttu toimib GPCR kui guaniininukleotiidi vahetustegur (inglise k. guanine nucleotide exchange factor, GEF), mis vahetab Gα alaühiku küljes oleva GDP GTP vastu. Traditsionaalse mudeli kohaselt põhjustab see GTP-ga seotud Gα alaühiku eraldumise Gβγ dimeerist ja retseptorist. Ka uusi mudeleid, kus viidatakse molekulaarsele ümberasetusele ja molekulide eel-komplekside moodustumisele on hakatud aktsepteerima.[6][7] Nii Gα-GTP kui ka Gβγ alaühikud saavad seejärel osaleda signaalikaskaadide ja efektorvalkude aktiveerimisel. Retseptor on samal ajal aga võimeline aktiveerima järgmist G-valku.[8]
Signaali peatamine[muuda | muuda lähteteksti]
Gα alaühik hüdrolüüsib sellega seotud GTP tagasi GDP-ks oma loomupärase ensümaatilise aktiivsuse kaudu. Seega saab Gα alaühik uuesti Gβγ kompleksiga liituda ja uus signaaliülekande tsükkel alata. Grupp valke, mida nimetatakse G-valgu signaaliülekande regulaatoriteks (inglise k. Regulator of G protein signalling, RGS), toimivad kui GTP-aase aktiveerivad valgud (GAP) ning nad on Gα alaühikule spetsiifilised. Need valgud kiirendavad GTP hüdrolüüsi GDP-ks ja seeläbi peatavad signaaliülekande. Mõnel juhul võib efektormolekul ise loomuomast GAP-aktiivsust omada ja seeläbi signaaliülekande peatada. See kehtib näiteks fosfolipaas C beeta korral, mis omab GAP-aktiivsust oma C-otsa läheduses. See on alternatiivne Gα alaühiku reguleerimise viis.
Spetsiifilised mehhanismid[muuda | muuda lähteteksti]
- Gsα stimuleerib cAMP tootmist adenosiintrifosfaadist (ATP), aktiveerides sellega cAMP-st sõltuva signaaliülekande raja. Sellega kaasneb otsene membraaniga seotud ensüümi adenülaaditsüklaas (AC) stimulatsioon. cAMP toimib kui sekundaarne virgatsaine, mis seostub ja aktiveerib proteiinkinaas A (PKA). Seejärel saab PKA fosforüleerida vajalikke molekule signaaliülekande rajal.
GPCR-ga on seotud kaks põhilist signaaliülekanderada, mis sõltuvad kas cAMP-st või fosfatidüülinositoolist.
cAMP-st sõltuvat signaaliülekande rada kasutavad mitmed hormoonid signaali edasiandmiseks. Nende hulka kuuluvad:
- ADH ehk antidiureeriline hormoon (vasopressiin) – soodustab vee tagasiimendumist neerudes;
- GHRH ehk kasvuhormooni vabastav hormoon (somatoliberiin) – stimuleerib kasvuhormooni (GH) sünteesi ja vabanemist;
- GHIH ehk kasvuhormooni inhibeeriv hormoon – takistab GH sünteesi ja vabanemist;
- CRH ehk kortikotropiini vabastajahormoon – stimuleerib adrenokortikotroopne hormoon ehk (ACTH) (kortikotropiin) sünteesi ja vabanemist;
- ACTH – stimuleerib kortisooli sünteesi ja vabanemist;
- TSH ehk kilpnääret stimuleeriv hormoon (türeotropiin) – stimuleerib suurema osa türoksiini (T4) sünteesi ja vabanemist;
- LH ehk luteiniseeriv hormoon (lutropiin) – toetab emastel ovulatsiooni ja corpus luteumi arengut ning isastel testosterooni tootmist ja spermatogeneesi;
- FSH ehk folliikuleid stimuleeriv hormoon (follitropiin) – stimuleerib emastel folliikuli arengut ja isastel spermatogeneesi;
- Kaltsitoniin – alandab kaltsiumitaset veres;
- Glükagoon – stimuleerib glükogeeni lagundamist glükoosikst;
- hCG ehk inimese koorioni gonadotropiin – stimuleerib rakkude diferentseerumist;
- Giα – inhibeerib cAMPi tootmist ATP-st;
- Gq/11α – stimuleerib rakumembraanil asuvat ensüümi fosfolipaas C beeta, mis lõhustab fosfoinositooli PIP2 kaheks sekundaarseks virgatsaineks, IP3 ja diatsüülglütserool (DAG).
Fosfatidüülinositoolist sõltuvat signaaliülekande rada kasutavad mitmed hormoonid signaali edasiandmiseks. Nende hulka kuuluvad:
- ADH
- TRH ehk türeotropiini vabastav hormoon – stimuleerib TSH sünteesi ja vabanemist.
- TSH
- Angiotensiin II – stimuleerib aldosterooni sünteesi ja vabanemist.
- GnRH ehk gonadotropiini vabastav hormoon – stimuleerib FSH ja LH sünteesi ja vabanemist.
- G12/13α on seotud Rho perekonna GTP-aasi signaaliülekandega. See juhib raku tsütoskelett remodelleerumist, seega reguleerides raku liikumist.
- Gβγ kompleksil on samuti aktiivseid funktsioone. Näiteks G-valguga seotud sissepoole korrigeerivate kaaliumikanalite (inglise k. G protein-coupled inwardly-rectifying potassium channels, GIRK) aktiveerimine ja nendega seostumine.
Väiksesed GTP-aasid[muuda | muuda lähteteksti]
Väikesed GTP-aasid seostuvad samuti GTP ja GDP-ga ning osalevad signaaliülekandes. Väikesed G-valgud on heterotrimeerse G-valgu alfa alaühiku homoloogid, kuid nad on monomeersed. Nad on väikesed (20–25 kDa) valgud. See valguperekond on homoloogiline Ras GTP-aasidega ning nad kuuluvad Ras superperekonda GTP-aasid.
Lipiidimine[muuda | muuda lähteteksti]
Plasmamembraani sisemise kihiga seostumiseks on paljud G-valgud ja väikesed GTP-aasid lipideeritud. See tähendab, et neil on kovalentsete sidemetega seotud rasvamolekulid. Nad võivad olla seotud müristoüül-, palmitoüül- või prenüülrühmaga.
Osad guaniininukleotiide siduvad valkude retseptorid võivad käituda onkogeenidena.
Vaata ka[muuda | muuda lähteteksti]
Viited[muuda | muuda lähteteksti]
- ↑ EC 3.6.5, Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB)Enzyme Nomenclature. Recommendations, Veebiversioon (vaadatud 22.10.2013) (inglise keeles)
- ↑ Hurowitz EH, Melnyk JM, Chen YJ, Kouros-Mehr H, Simon MI, Shizuya H (2000). "Genomic characterization of the human heterotrimeric G protein alpha, beta, and gamma subunit genes". DNA Res. 7 (2): 111–20. DOI:10.1093/dnares/7.2.111. PMID 10819326.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Reece J, C N (2002). Biology. San Francisco: Benjamin Cummings. ISBN 0-8053-6624-5.
- ↑ Neves SR, Ram PT, Iyengar R (mai 2002). "G protein pathways". Science. 296 (5573): 1636–9. DOI:10.1126/science.1071550. PMID 12040175.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Wu G (2010). "Assays with GPCRs". Assay Development: Fundamentals and Practices. New York: Wiley. ISBN 0-470-19115-5.
- ↑ Digby GJ, Lober RM, Sethi PR, Lambert NA. (2006). "Some G protein heterotrimers physically dissociate in living cells". Proc Natl Acad Sci USA. 103 (47): 17789–94. DOI:10.1073/pnas.0607116103. PMC 1693825. PMID 17095603.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Khafizov K, Lattanzi G, Carloni P (2009). "G protein inactive and active forms investigated by simulation methods". PROTEINS : Structure, Function, and Bioinformatics. 75 (4): 919–30. DOI:10.1002/prot.22303. PMID 19089952.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Yuen JW, Poon LS, Chan AS, Yu FW, Lo RK, Wong YH (juuni 2010). "Activation of STAT3 by specific Galpha subunits and multiple Gbetagamma dimers". Int. J. Biochem. Cell Biol. 42 (6): 1052–9. DOI:10.1016/j.biocel.2010.03.017. PMID 20348012.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link)
Välislingid[muuda | muuda lähteteksti]
| Pildid, videod ja helifailid Commonsis: G-valgud |
- Rakkudevaheline signalisatsioon
- Daisuke Urano, Jin-Gui Chen, José Ramón Botella, Alan M. Jones,Heterotrimeric G protein signalling in the plant kingdom, doi: 10.1098/rsob.120186, Open Biol. March 2013 Veebiversioon (vaadatud 22.10.2013) (inglise keeles)
