Adenosiintrifosfaat
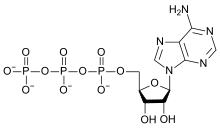

Adenosiintrifosfaat ehk adenosiin-5'-trifosfaat ehk adenosiin-5’-(tetravesinik-trifosfaat) (lühend ATP) on universaalne energia talletaja ja ülekandja, mis osaleb kõigi rakkude metabolismis. ATP on makroergiline ühend.
ATP-d toodetakse kõige rohkem mitokondrites. Taimedes ja vetikates toimub intensiivne ATP moodustumine kloroplastides.
ATP on madalmolekulaarne ühend, mis koosneb adeniinist, riboosist ja kolmest lineaarselt seotud fosfaadijäägist, mis on omavahel ühendatud fosfoanhüdriidsidemetega. Esimene fosfaat seondub estrina riboosi 5'-hapnikuaatomiga, teised kaks on seotud happeanhüdriididena. ATP molekuli keemiline valem on C10H16N5O13P3.
2. ja 3. fosfaadi sidemed on väga energiarikkad ja kergesti katkevad. Kokku vabaneb energiat 8–10 kcal/mol ehk umbes 30 kJ/mol. ATP pöörduv hüdrolüüs võib jätta alles adenosiinmonofosfaadi, kusjuures eraldub pürofosfaat, või adenosiindifosfaadi, kusjuures eraldub ortofosfaat.
ATP funktsioon[muuda | muuda lähteteksti]
ATP on multifunktsionaalne nukleosiidtrifosfaat, mida kasutatakse rakkudes koensüümina. Tihtipeale kutsutakse seda "molekulaarseks valuutaks" rakusisesel energiaülekandel.[1] Keemilise energia kandjana etendab ATP olulist rolli metabolismis. Lisaks on see üks fotofosforüleerimise ja raku hapnikutarbimise lõppsaadusi. Rakusisestes protsessides vajavad ATP-d paljud ensüümid ja struktuurvalgud (näiteks biosünteetilistes reaktsioonides ja raku jagunemisel).[2]
Üks ATP molekul, mida toodab ATP-süntaas anorgaanilisest fosfaadist ja adenosiindifosfaadist (ADP) või adenosiinmonofosfaadist (AMP) sisaldab kolme fosfaatrühma. Adenosiintrifosfaadi sünteesiks on kolm võimalust: otsene fosfaatrühma ülekanne AMP-le või ADP-le, oksüdatiivne fosforüülimine rakusisese hapnikutarbe käigus ja fotofosforüleerimine fotosünteesil.
Ainevahetuse protsessid, mis kasutavad ATP-d energiaallikana, muudavad selle pärast kasutamist tagasi lähteaineteks, millest seda esialgu toodeti (anorgaaniline fosfaat ning AMP või ADP). Seega on ATP organismis pidevas ringluses. Inimkeha, mis sisaldab keskmiselt kõigest 250 grammi ATP-d,[3] töötab seda pidevalt ümber võrdeliselt oma kehakaaluga.[4]
ATP-d kasutatakse substraadina nii kinaaside kui ka adenülaadi tsüklaasi poolt. Kinaasid on ensüümid, mis aitavad fosfaatrühmi kõrge energiaga molekulidelt (ATP) näiteks valkudele ja lipiididele üle kanda. Adenülaadi tsüklaas katalüüsib sekundaarse virgatsaine cAMP (adenosiin-3’,5’-monofosfaadi) moodustumist.
Rakud kasutavad ATP ja AMP koguste vahelist suhet mitmeks otstarbeks. Esiteks selleks, et teha kindlaks, kui palju energiat, mida organism saaks kulutada, on saadaval. Teiseks selleks, et kontrollida metabolismiradade tegevust, mille käigus nii toodetakse kui ka tarbitakse ATP-d.[5] Lisaks mängib ATP olulist rolli DNA replikatsioonil ja transkriptsioonil. Arvatakse, et ATP näol on tegemist neurotransmitteriga, mis vahendab haistmismeele signaaliülekandeid.[6]
ATP struktuurist on näha, et see koosneb puriinalusest (adeniin), mis paikneb pentoosisuhkru (riboos) ahela esimese süsiniku aatomi (1’-süsinik) küljes. Kolm fosfaatrühma paiknevad aga pentoosisuhkru viienda süsiniku (5’-süsinik) küljes. Fosfaatrühmade liitmine ja eemaldamine võimaldab ATP muutmist ADP-ks ja AMP-ks ning vastupidi. Kui DNA sünteesil kasutatakse ATP-d, siis muudetakse riboos spetsiaalsete ensüümide (ribonukleotiidreduktaas) abil desoksüriboosiks.
Füüsikalised ja keemilised omadused[muuda | muuda lähteteksti]
ATP koosneb adenosiinist (mis omakorda koosneb adeniinist ja riboosisuhkrust) ning kolmest fosfaatrühmast (trifosfaadist). Fosfaatrühmi fosforüülgrupis nimetatakse, alustades riboosile lähimast, vastavalt alfa- (α), beeta- (β) ja gamma- (γ) fosfaatideks. Struktuurist võib järeldada, et see on väga lähedalt seotud andenosiini nukleotiidiga ehk teisisõnu RNA monomeeriga. ATP on vees väga hästi lahustuv molekul. Äärmusliku pH-ga lahustes hüdrolüüsub ATP suure kiirusega. Lahustes, mille pH on vahemikus 6,8–7,4 on molekul küllaltki stabiilses olekus.[7]
Ilma puhveromaduseta vees muutub ATP ebastabiilseks, mistõttu see hüdrolüüsub ADP-ks ja fosfaadiks. Hüdrolüüsiprotsess leiab aset sellepärast, et sidemetugevus ATP fosfaatrühmade vahel on väiksem kui hüdrolüüsi tulemusel tekkivate produktide (ADP ja fosfaat) ning vee vahel moodustuvate vesiniksidemete tugevus. Seega kui ATP ja ADP on vesilahuses keemilises tasakaalus, siis peaaegu kogu ATP muudetakse lõpuks ADP-ks. Süsteem, mis on tasakaaluolekust kaugel, sisaldab Gibbsi vabaenergiat (ΔG) ning on seetõttu võimeline tegema tööd. Elusrakkudes on ATP ja ADP vaheline suhe 0,1 suurusjärku tasakaaluolekus esinevast suhtest kõrgem ning ATP kontsentratsioon on umbes 1000 korda suurem kui ADP kontsentratsioon. Seesugune nihe tasakaaluolekust tähendab seda, et tänu ATP hüdrolüüsile rakus eraldub suurtes kogustes vabaenergiat.[8]
ATP on niivõrd kõrge energiasisaldusega molekul tänu kahele fosfaatrühmade vahelisele sidemele. Neid sidemeid nimetatakse fosfoanhüdriidsidemedeks.[9] Energia, mis on ATP molekulis salvestatud, vabaneb eelpool mainitud anhüdriidsidemete hüdrolüüsil.[9] Energia puudujäägi korral anaboolses reaktsioonis eraldub energia saamiseks hüdrolüüsi käigus ATP-lt esimesena γ-fosfaatrühm. Kuna γ-fosfaatrühm asub riboosist võrreldes teiste fosfaatrühmadega kõige kaugemal, on sellel nii alfa- kui ka beetafosfaatrühmast suurem lõhustumisenergia. Pärast hüdrolüüsiprotsessi (või fotofosforüleerimise protsessi ATP-ga) moodustuvate sidemete energiatasemed on madalamad, kui ATP's leiduvate fosfoanhüdriidsidemete omad. Ensüümkatalüüsi abil aset leidva ATP hüdrolüüsi või ATP-ga fotofosforüleerimisel tekkiv vabaenergia võidakse elusolendite poolt ära kasutada töö tegemisel.[10][11]
Iga ebastabiilne süsteem, mis sisaldab reaktsioonivõimelisi molekule, võiks teoreetiliselt olla energia salvesti. See aga oleks võimalik vaid juhul, kui rakk suudaks säilitada antud molekuli sellise kontsentratsiooni, mis on reaktsiooni tasakaaluolekust kaugel.[8] Kuid nagu paljude teiste polümeersete biomolekulide puhul, toimub ka RNA, DNA ja ATP lagunemine lihtsamateks monomeerideks lähtuvalt energia vabanemise ja entroopia suurenemise reeglitest. Seda nii standardsete kontsentratsioonide kui ka rakus olevate kontsentratsioonide korral.
Standardset energiahulka, mis vabaneb ATP hüdrolüüsil, on võimalik välja arvutada muutuste põhjal, mis toimuvad reaktsioonis standardtingimustel. Saadud andmete abil on arvutuste tulemusi võimalik muuta nii, et need vastaks bioloogilistele kontsentratsioonidele. Reaktsioonientalpia muutus ATP hüdrolüüsumisel ADP-ks ja anorgaaniliseks fosfaadiks standardsel temperatuuril ja rõhul on −20,5 kJ/mol. Sama protsessi vabaenergia muut on 3,4 kJ/mol.[12] Eraldades 1 M kontsentratsiooniga lahuses standardtingimustel ATP-lt kas fosfaatrühma (Pi) või pürofosfaatrühma (PPi), vabanevad järgnevad energiahulgad:[13]
ATP + H2O → ADP + Pi ΔG˚ = −30,5 kJ/mol (−7,3 kcal/mol)
ATP + H2O → AMP + PPi ΔG˚ = −45,6 kJ/mol (−10,9 kcal/mol)
Neid andmeid võib kasutada, et arvutada nii energiamuutu füsioloogilistes tingimustes kui ka rakusisest ATP ja ADP vahelist suhet. Üha enam hakatakse aga kasutama sellist energiahulka, mis arvestab lisaks ATP ja ADP kogusele ka AMP kogust. Selle reaktsiooni Gibbsi vabaenergia sõltub aga mitmest muust faktorist, sealhulgas üldisest lahuse ioontugevusest ja leelismuldmetallide (nt Mg2+ ja Ca2+) sisaldusest. Tavapärastes rakusisestes tingimustes on sellise Gibbsi vabaenergia väärtus umbes −57 kJ/mol (−14 kcal/mol).[14]
Ionisatsioon bioloogilistes süsteemides[muuda | muuda lähteteksti]
Adenosiintrifosfaat sisaldab mitut asendusrühma, millel on erinevad happe dissotsiatsioonikonstandid. Neutraalses lahuses esineb ATP enamasti ioniseerunud vormis (enamus on vormis ATP4−, kuid lisaks sellele esineb ka vähesel hulgal ATP3− ioone).[15] Kuna ATP esineb neutraalses lahuses erinevates negatiivselt laetud vormides, siis võib see tänu kõrgele afiinsusele metallidega kelaatuda. Järgnevalt on toodud mõnede metalliioonide sidumiskonstandid (konstant on antud 1 mooli kohta): Mg2+ (9554), Na+ (13), Ca2+ (3722), K+ (8), Sr2+ (1381), Li+ (25).[16] Nagu konstantide väärtusest järeldada võib, moodustab ATP kompleksi enamasti Mg2+ ioonidega.[15][17]
Uurimislugu[muuda | muuda lähteteksti]
ATP avastasid 1929. aastal Karl Lohmann[18] ning temast sõltumatult Harvard Medical Schooli teadlased Cyrus Fiske ja Yellapragada Subbarow.
Detsembris 1928 isoleeris Lohmann Berliinis uurimisasutuse Kaiser-Wilhelm-Institut für Biologie füsioloogiaosakonnas kuuma soolhappe abil värsketest küülikulihastest aine, millest vabanesid fosfaatioonid, adeniin ja pentoosfosforhape. Ta tegi kindlaks ka koostisosade vahekorra. Ta pani ainele nimeks "adenüülpürofosforhape". Suvel 1929 tutvustas ta seda ainet rahvusvahelisel füsioloogide kongressil Bostonis ning 2. augustil 1929 ilmus artikkel (Lohmann 1929). Tulemus ei pakkunud kolleegidele suurt huvi.[19]
Lohmann hakkas koos oma ülemuse, füsioloogia osakonna juhataja Otto Fritz Meyerhofiga uurima selle aine funktsiooni organismis. Nad avastasid, et lihase kokkutõmmet võimaldab fosfaatjäägi eraldumine ATP-st. Selles reaktsioonis vabaneb sama palju energiat nagu fosfaatrühma eraldumisel kreatiinfosfaadist. Viimasest saavad lihased umbes viis korda rohkem rohkem energiat kui ATPst. Meyerhof ja Lohmann tegid järelduse, et kreatiinfosfaat on lihases keskmise säilitusajaga energiatalletaja. Kui lihase kokkutõmbel eraldub ATP-st fosfaatrühm, saab kreatiinfosfaat selle kaotuse korvata, andes adenosiindifosfaadile fosfaatrühma, nii et sellest saab jälle ATP.[20]
Aastal 1930 läksid nad üle Heidelbergi uude uurimisasutusse Kaiser-Wilhelm-Institut für medizinische Forschung.
ATP täpne ehitus tehti kindlaks alles mõned aastad hiljem. ATP funktsiooni peamise energiakandjana rakus avastas Fritz Albert Lipmann 1941. aastal.[21] 1948. aastal sünteesis Alexander Todd ATP-d esimesena tehislikult.[22]
Viited[muuda | muuda lähteteksti]
- ↑ Knowles JR (1980). "Enzyme-catalyzed phosphoryl transfer reactions". Annu. Rev. Biochem. 49: 877–919. DOI:10.1146/annurev.bi.49.070180.004305. PMID 6250450.
- ↑ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 0-13-250882-6.
- ↑ "'Nature's Batteries' May Have Helped Power Early Lifeforms". Science Daily. 25. mai 2010. Originaali arhiivikoopia seisuga 27.05.2010. Vaadatud 26.05.2010.
At any one time, the human body contains just 250g of ATP — this provides roughly the same amount of energy as a single AA battery. This ATP store is being constantly used and regenerated in cells via a process known as respiration, which is driven by natural catalysts called enzymes.
- ↑ Törnroth-Horsefield S, Neutze R (detsember 2008). "Opening and closing the metabolite gate". Proc. Natl. Acad. Sci. U.S.A. 105 (50): 19565–6. DOI:10.1073/pnas.0810654106. PMC 2604989. PMID 19073922.
- ↑ Hardie DG, Hawley SA (detsember 2001). "AMP-activated protein kinase: the energy charge hypothesis revisited". BioEssays. 23 (12): 1112–9. DOI:10.1002/bies.10009. PMID 11746230.
- ↑ Tim Jacob. "Taste(gustation)". Vaadatud 14. juulil 2012.
- ↑ Stecher P.G., ed. (1968). The Merck Index: an encyclopedia of chemicals and drugs 8th edition. Merck and Co. Ltd.
{{cite book}}: parameetris|author=on üldnimi (juhend) - ↑ 8,0 8,1 Ferguson, S. J.; Nicholls, David; Ferguson, Stuart (2002). Bioenergetics 3 (3rd ed.). San Diego: Academic. ISBN 0-12-518121-3.
{{cite book}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ 9,0 9,1 JM Berg, JL Tymoczko, L. Stryer (2003). Biochemistry. New York: WH Freeman and Company. Lk 376 isbn = 0-7167-4684-0.
{{cite book}}: puuduv püstkriips kohas:|page=(juhend)CS1 hooldus: mitu nime: autorite loend (link) - ↑ Koolman, J.; K. H. Roehm (2005). Color Atlas of Biochemistry. Stuttgart, Germany: Georg Thieme Verlag. Lk 122. ISBN 3-13-100372-3.
- ↑ ed. by John Daintith. (2004). Oxford Dictionary of Chemistry. Oxford, England: Oxford University Press. Lk 435. ISBN 0-19-860918-3.
{{cite book}}: parameetris|author=on üldnimi (juhend) - ↑ Gajewski E, Steckler D, Goldberg R (1986). "Thermodynamics of the hydrolysis of adenosine 5'-triphosphate to adenosine 5'-diphosphate" (PDF). J Biol Chem. 261 (27): 12733–7. PMID 3528161. Originaali (PDF) arhiivikoopia seisuga 27. september 2007. Vaadatud 19. novembril 2012.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (2007). Biochemistry (6th ed.). New York: W. H. Freeman. Lk 413. ISBN 0-7167-8724-5.
- ↑ Stryer, Lubert (2002). Biochemistry (5th ed.). New York: W.H. Freeman and Company. ISBN 0-7167-1843-X.
- ↑ 15,0 15,1 Storer A, Cornish-Bowden A (1976). "Concentration of MgATP2− and other ions in solution. Calculation of the true concentrations of species present in mixtures of associating ions". Biochem J. 159 (1): 1–5. PMC 1164030. PMID 11772.
- ↑ Wilson J, Chin A (1991). "Chelation of divalent cations by ATP, studied by titration calorimetry". Anal Biochem. 193 (1): 16–9. DOI:10.1016/0003-2697(91)90036-S. PMID 1645933.
- ↑ Garfinkel L, Altschuld R, Garfinkel D (1986). "Magnesium in cardiac energy metabolism". J Mol Cell Cardiol. 18 (10): 1003–13. DOI:10.1016/S0022-2828(86)80289-9. PMID 3537318.
{{cite journal}}: CS1 hooldus: mitu nime: autorite loend (link) - ↑ Lohmann 1929.
- ↑ Emmerich 2012: 86.
- ↑ Emmerich 2012: 87.
- ↑ Lipmann F (1941). Adv. Enzymol. 1: 99–162. ISSN 0196-7398.
{{cite journal}}: puuduv või tühi pealkiri:|title=(juhend) - ↑ "History: ATP first discovered in 1929". The Nobel Prize in Chemistry 1997. Nobel Foundation. Vaadatud 26.05.2010.
Kirjandus[muuda | muuda lähteteksti]
- Karl Lohmann. Über die Pyrophosphatfraktion im Muskel. – Naturwissenschaften, kd 17, nr 31, lk 624–626, 1929.
- Maren Emmerich. Zellen lassen die Muskeln spielen. – MaxPlanckForschung 4/12, 2012, lk 86–87. Veebis.
- Erwin Schrödinger, "Mis on elu? Vaim ja aine. Autobiograafilisi visandeid". Tõlkinud Ruth Lias Kirjastus: Ilmamaa 2015 ISBN 9789985775363 Raamatu järelsõnas "Elu jõud", lk 249–250 selgitab Agu Laisk suurepärasel viisil ATP ehitust ja tööpõhimõtet.
Välislingid[muuda | muuda lähteteksti]
| Pildid, videod ja helifailid Commonsis: Adenosiintrifosfaat |
- Adenosiintrifosfaat imetajatel
- Guy C. BROWN, Control of respiration and ATP synthesis in mammalian mitochondria and cells, Biochem. J. (1992) 284, 1–13, veebiversioon (vaadatud 28.11.2014.a.)(inglise keeles)
- Burnstock G., Physiology and pathophysiology of purinergic neurotransmission., Physiol Rev. aprill 2007;87(2):659–797
- H. M. KLOUWEN ja A. W. M. APPELMAN, Synthesis of Adenosine Triphosphate in Isolated Nuclei and Intact Cells, Biochem. J. (1967) 102, 878 – 884, PMCID: PMC1270339, veebiversioon (vaadatud 28.11.2014.a.)(inglise keeles)
